

Un islote pancreático con escasa marcación de insulina del grupo de roedores tratados con STZ, antibiótico y MDP, que muestra el proceso de destrucción contra las células beta productoras de insulina (imagen: divulgación)
Un estudio brasileño indica que componentes bacterianos pueden activar receptores del sistema inmunológico innato y contribuir al desarrollo de una respuesta adaptativa contra las células beta productoras de insulina
Un estudio brasileño indica que componentes bacterianos pueden activar receptores del sistema inmunológico innato y contribuir al desarrollo de una respuesta adaptativa contra las células beta productoras de insulina
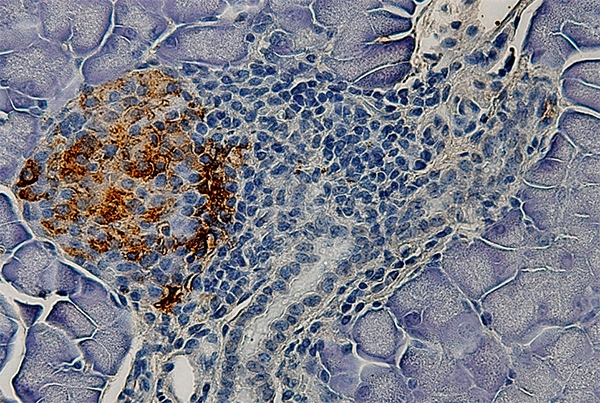
Un islote pancreático con escasa marcación de insulina del grupo de roedores tratados con STZ, antibiótico y MDP, que muestra el proceso de destrucción contra las células beta productoras de insulina (imagen: divulgación)
Por Karina Toledo | Agência FAPESP – Estudios recientes han demostrado que portadores de diabetes padecen a menudo un desequilibrio entre las bacterias benéficas y las bacterias patogénicas que componen la microbiota intestinal, lo que configura una condición conocida con el nombre de disbiosis, que es potencialmente perjudicial para el organismo. No obstante, no está claro si ésta es una de las causas o una consecuencia de dicha enfermedad metabólica.
Pero nuevas evidencias publicadas por científicos brasileños en Journal of Experimental Medicine sugieren que cuando las bacterias intestinales logran escapar hacia los ganglios linfáticos ubicados cerca del páncreas –debido a alteraciones en la permeabilidad de la pared del intestino causadas por el proceso de disbiosis–, pueden activar ciertos receptores existentes en células del sistema inmunológico innato (la primera línea de defensa del organismo), particularmente en los macrófagos y en las células dendríticas.
Según los autores de la referida comunicación, esa activación induciría una condición proinflamatoria en el organismo y favorecería el desarrollo de una respuesta inmunológica dirigida (adaptativa) a las células beta productoras de insulina del páncreas, un proceso que resulta en la llamada diabetes tipo 1 o autoinmune.
“La etapa final de desarrollo de la diabetes tipo 1 ya se comprende claramente. Se sabe que en un determinado momento, el sistema inmunológico empieza a considerar a las células beta del páncreas como algo extraño al organismo. Por consiguiente, células específicas conocidas como linfocitos T se activan y se producen anticuerpos cuyo objetivo es destruir a las productoras de insulina. Sin embargo, aún no está claro cuáles son los disparadores que se accionan en el sistema inmunológico innato para inducir la respuesta inmunológica adaptativa. En este estudio, demostramos que existe una participación de un receptor intracelular llamado NOD2”, comentó Daniela Carlos, investigadora de la Facultad de Medicina de Ribeirão Preto, perteneciente a la Universidad de São Paulo (FMRP-USP), y coordinadora de la investigación que contó con el apoyo de la FAPESP.
Las conclusiones que se leen en el artículo se basan en experimentos con ratones realizados durante la maestría de Frederico R. C. Costa, bajo la dirección de Carlos y con la colaboración del profesor João Santana Silva, de la FMRP-USP.
En los ensayos, el grupo observó que ratones genéticamente modificados para no expresar la proteína NOD2 presentaban resistencia al desarrollo de la diabetes tipo 1 aun cuando se los desafiaba mediante un estímulo químico.
“Para inducirles diabetes a roedores sanos en laboratorio, se les administra una droga llamada estreptozotocina, que es tóxica para las células beta del páncreas. La muerte de dichas células funciona como una señal inflamatoria y entonces se activan y se despliegan hacia el lugar otras células de defensa, que reconocen y atacan a las células beta productoras de insulina. Se les aplica la sustancia a los animales durante cinco días consecutivos y, al cabo de 15 días, los mismo se han vuelto diabéticos”, explicó Carlos.
La confirmación de la enfermedad se realiza mediante análisis como el de glucemia en ayunas, y de tolerancia a la glucosa y a la insulina. No obstante, todos estos parámetros clínicos se mantuvieron inalterables en los animales a los que se les aplicó estreptozotocina; pero no expresaban NOD2.
El perfil del sospechoso
De acuerdo con la explicación de Campos, el rol de este receptor figura descrito claramente en la literatura científica. El NOD2 está presente en las células de defensa y del epitelio intestinal, y cumple la función de reconocer la presencia de uno de los componentes bacterianos, el MDP (el muramil dipéptido). Cuando se activa, este receptor induce una señalización intracelular que resulta en la expresión de péptidos antimicrobianos y citocinas inflamatorias, tales como la interleucina 1 beta (IL-1β), la interleucina 6 (IL-6) y la interleucina 23 (IL-23), sustancias que participan en la activación y en la migración de células de defensa hacia el intestino. De este modo, el NOD2 desempeña un papel esencial en la inmunidad local y sistémica, al mantener la integridad de la barrera intestinal y controlar la translocación bacteriana del lumen (la cavidad interna del intestino) a la mucosa.
“Decidimos investigar la participación de la proteína NOD2 en la patogénesis de la diabetes tipo 1 porque en estudios anteriores se describió la asociación entre una microbiota alterada y el desarrollo de la diabetes autoinmune en humanos y en modelos experimentales. Sin embargo, los mecanismos por los cuales las bacterias intestinales llevan a la patología seguían siendo nebulosos. En ese contexto, el receptor NOD2, que es importante debido a que ayuda en el mantenimiento de la homeostasis intestinal, surgió como un blanco clave de estudio”, explicó Carlos.
De acuerdo con la investigadora, las células del sistema inmunológico innato están ofreciéndoles continuamente todos los autoantígenos (propios del organismo) a los linfocitos T. Normalmente, esto ocurre en un contexto “tolerogénico”, o dicho en otras palabras: el sistema inmunológico innato les indica a los linfocitos T –a través de la interleucina 10– (IL-10), que adopten un perfil regulador (inmunosupresor).
No obstante, de acuerdo con la teoría del grupo de Ribeirão Preto, cuando componentes bacterianos activan al receptor NOD2 en células dendríticas y macrófagos, las citocinas inflamatorias liberadas inducen la generación de un ambiente inflamatorio, es decir: los linfocitos T pasan a recibir una señal distinta y se convierten en células patogénicas, capaces de reconocer y atacar a las células beta productoras de insulina.
Tal como se mencionó anteriormente, es necesario que se produzca también la muerte celular de las células beta pancreáticas y la consiguiente liberación de autoantígenos para generar el contexto inflamatorio. En los animales de laboratorio, la muerte celular se induce mediante la aplicación de estreptozotocina. En humanos, según Carlos, la causa puede ser un factor ambiental, tal como una infección viral, por ejemplo.
Validación
Para validar la importancia de los receptores NOD2 en la patogénesis de la diabetes tipo 1 y confirmar la participación de las bacterias intestinales en su activación, se realizó un segundo experimento con ratones.
En esta oportunidad, se redujo la microbiota intestinal de un grupo de roedores mediante la aplicación de un potente coctel de antibióticos. Al desafiárselo a través de la administración de estreptozotocina, el grupo se mostró resistente al desarrollo de la enfermedad, aun siendo capaz de expresar NOD2. Para los investigadores, esto se relaciona con la eliminación de bacterias en los linfonodos pancreáticos.
En tanto, en otro conjunto de animales también se redujo la microbiota intestinal, pero además de estreptozotocina, se aplicaron inyecciones de MDP, una molécula presente en diversas bacterias y capaz de activar NOD2. En este caso, los animales se volvieron diabéticos.
“Por lo tanto, estos resultados confirman que existe alguna bacteria reconocida vía NOD2 en los linfonodos pancreáticos que participa en el desarrollo de la diabetes tipo 1. No logramos descubrir cuál es exactamente la especie bacteriana, pero ahora pretendemos llevar a cabo un análisis metagenómico más vasto para intentar identificarla”, dijo Carlos.
Según la investigadora, con base en estas evidencias, el próximo paso consistirá en poner a prueba algunas intervenciones preventivas o terapéuticas, tales como la modulación de la microbiota intestinal mediante el empleo de compuestos probióticos y prebióticos o la inhibición del receptor NOD2 con drogas farmacológicas.
Daniela Carlos también presentó los resultados publicados en Journal of Experimental Medicine durante el FAPESP/EU-LIFE Symposium on Cancer Genomics, Inflammation & Immunity. Este evento, realizado entre los días 7 y 9 de junio en la sede de la FAPESP, en São Paulo, tuvo el objetivo de fomentar la colaboración entre científicos del estado de São Paulo y de Europa.
Puede leerse el artículo intitulado Gut microbiota translocation to the pancreatic lymph nodes triggers NOD2 activation and contributes to T1D onset (doi: 10.1084/jem.20150744) ingresando al siguiente enlace: jem.rupress.org/content/213/7/1223.abstract.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





