

El estudio se llevó a cabo en el Centro de Investigaciones sobre el Genoma Humano y Células Madre, y contó con el apoyo de la FAPESP (imagen: reproducción de Stem Cells International)
Un tratamiento con células madre humanas extendió un 50% la vida de los roedores en una investigación brasileña dada a conocer en la revista Stem Cells International
Un tratamiento con células madre humanas extendió un 50% la vida de los roedores en una investigación brasileña dada a conocer en la revista Stem Cells International
El estudio se llevó a cabo en el Centro de Investigaciones sobre el Genoma Humano y Células Madre, y contó con el apoyo de la FAPESP (imagen: reproducción de Stem Cells International)
Por Karina Toledo
Agência FAPESP – Un tratamiento con células madre mesenquimales humanas extendió un 50% la vida de ratones con cáncer de mama, en el marco de experimentos realizados en la Universidad de São Paulo (USP) y en la Universidad Federal de São Paulo (Unifesp), en Brasil.
Esta investigación se llevó a cabo en el Centro de Investigaciones sobre el Genoma Humano y Células Madre, uno de los CEPIDs que cuentan con el apoyo de la FAPESP. Y los resultados se dieron a conocer en la revista Stem Cells International.
“La terapia con células mesenquimales no curó la enfermedad, pero sí retrasó su progresión. A los animales les aplicamos tan sólo dos inyecciones de células madre. Es posible que un tratamiento continuo, aliado a la cirugía de extirpación del tumor, tenga un resultado más significativo aún”, comentó Tatiana Jazedje, coordinadora de la investigación que contó con el apoyo de la FAPESP.
Las células madre mesenquimales están presentes prácticamente en todos los órganos humanos, como así también en los de roedores, y ayudan en la supervivencia de los tejidos al producir diversos factores que suministran soporte para el crecimiento y la diferenciación celular. Aunque no tienen capacidad para diferenciarse en todos los tejidos del cuerpo, tal como lo hacen las células madre embrionarias, tienen interés desde el punto de vista terapéutico, pues poseen propiedades antiinflamatorias, antiapoptóticas (evitan la muerte celular) e inmunomoduladoras, que se están sometiendo a pruebas contra diversas enfermedades.
Puede extraérselas fácilmente de la medula ósea o del tejido adiposo, y también puede expandírselas mediante cultivo en laboratorio. En el caso de la investigación realizada en el IB-USP, se las extrajo de tejido de trompas de Falopio humanas desechados luego de cirugías de ligadura.
“Empleamos un linaje de células mesenquimales que nuestro grupo describió por primera vez en 2009, en la publicación Journal of Translational Medicine. Por el ambiente en que se hallan originariamente, suponemos que desempeñan un papel inmunomodulador importante en la fertilización. Como el cáncer de mama es una enfermedad que afecta predominantemente a mujeres, decidimos evaluar el efecto de estas células en el tratamiento de los mencionados tumores”, comentó Jazedje.
De acuerdo con la investigadora, los estudios que habían realizado anteriormente otros grupos con ese objetivo presentaban contradicciones. Para Jazedje, la explicación de ello reside en el hecho de que las metodologías utilizadas eran sumamente distintas, lo cual impide establecer comparaciones.
“Variaba el linaje de ratones utilizado, la edad de los animales, la forma de administración de las células y el estadio de la enfermedad en que comenzó el tratamiento. Además, en algunos casos, se trabajó con roedores inmunosuprimidos, lo que considero que no es una buena opción. Cuando el sistema inmunológico no funciona, todo marcha peor y la causa no está necesariamente en las células mesenquimales”, comentó la investigadora.
El grupo del IB optó por administrar las células madre mesenquimales por vía intraperitoneal, es decir, mediante la aplicación de inyecciones en la zona del peritoneo –la membrana que reviste los órganos de la cavidad abdominal–, en ratones del linaje Balb-c.
Para inducir el cáncer, se aplicaron células tumorales del linaje 4T1 –el más utilizado en estudios de este tipo– en la grasa mamaria de los ratones. Siete días después del procedimiento, los animales exhibían pequeños tumores palpables, y entonces se inició el tratamiento.
A un primer grupo se le administró únicamente un placebo. Al segundo grupo se le aplicó una dosis de las células mesenquimales (un millón de células) al séptimo día después de la inducción del tumor. Y el tercero grupo recibió dos dosis del tratamiento: la primera al séptimo día y la segunda una semana después.
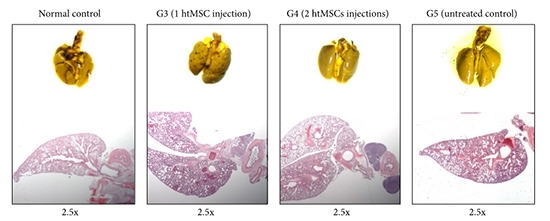
Los animales del grupo de control murieron entre 30 y 35 días después de la inducción del tumor. El grupo al que se le administró tan sólo una dosis del tratamiento no exhibió ninguna diferencia estadística significativa con relación al grupo de control. En tanto, los animales tratados con dos dosis de células mesenquimales vivieron hasta los 45 días después de la inducción del tumor, lo que representa una extensión de la vida de un 50% con respecto a los ratones del grupo de control.
En un otro experimento, los científicos mezclaron células madre mesenquimales y células tumorales. Luego les inyectaron esa mezcla a ratones sanos del mismo linaje Balb-c.
“Esos animales murieron sólo 15 días después de la inducción del tumor, o sea que tuvieron una evolución clínica mucho peor que la del grupo de control no tratado del experimento anterior. De este modo, arribamos a la conclusión de que, cuando se aplica esa co-inyección, los factores liberados por las células mesenquimales favorecen la proliferación del tumor y la formación de metástasis, lo cual provoca la muerte prematura de los animales”, dijo la investigadora.
Otras fuentes
El grupo probó en el mismo modelo animal del primer experimento el tratamiento con células mesenquimales humanas extraídas de la medula ósea y del tejido adiposo. No obstante, en esos casos no se obtuvieron resultados tan buenos como los que se observaron con las células extraídas de la trompa de Falopio.
Al probar un tratamiento con células mesenquimales murinas (extraídas de ratones), los investigadores no registraron una prolongación de la vida. Con todo, sí se detectó una mejora en otros aspectos, tales como la disminución de la inflamación pulmonar y una menor formación de metástasis. Una parte de este trabajo estuvo a cargo de Aline Ribeiro, alumna de Iniciación a la Investigación Científica y becaria FAPESP.
Durante la maestría de Mayra Vitor Pelatti, realizada bajo la dirección de Jazedje, se realizaron hechos experimentos in vitro con miras a develar cuál fue el mecanismo o el tratamiento con células humanas que retrasó la progresión del tumor en el primer experimento.
Al poner en el mismo cultivo células mesenquimales y células tumorales, el grupo observó una merma en la producción de la proteína VEGF (Factor de Crecimiento Endotelial Vascular, por sus siglas en inglés), que es importante para la formación de nuevos vasos sanguíneos que nutrirán al tumor.
“La proteína VEGF es una citocina fuertemente relacionada con la angiogénesis. Por eso mismo, una merma de su producción puede desacelerar el crecimiento tumoral, lo cual resulta benéfico para el individuo que padece la enfermedad”, comentó Jazedje.
A juicio de la investigadora, estos hallazgos demuestran que la misma célula mesenquimal puede tener efectos buenos o malos: depende de cómo se la aplique.
“Además, sabemos que no todas las células madre mesenquimales extraídas de las trompas de Falopio se comportan de la misma manera. Cada una tiene un perfil distinto, según la donante. Tienen potencial para su utilización como coadyuvantes en el tratamiento del cáncer de mama, pero, para estar seguros, es necesario realizar aún nuevos estudios”, sostuvo.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





