

Una célula modificada genéticamente con el objetivo de que exprese una enzima que produce luz sirvió de herramienta para monitorear el fenómeno de la repoblación tumoral (foto: divulgación)
Estudios indican que la unión de la radioterapia con fármacos capaces de bloquear la acción de una proteína denominada PAFR puede elevar el índice de éxito de los tratamientos y disminuir las recidivas
Estudios indican que la unión de la radioterapia con fármacos capaces de bloquear la acción de una proteína denominada PAFR puede elevar el índice de éxito de los tratamientos y disminuir las recidivas
Una célula modificada genéticamente con el objetivo de que exprese una enzima que produce luz sirvió de herramienta para monitorear el fenómeno de la repoblación tumoral (foto: divulgación)
Por Karina Toledo | Agência FAPESP – Siempre que el organismo sufre una agresión –ya sea un simple corte en el dedo o una cirugía– las células ubicadas alrededor de la lesión reciben señales indicativas de que deben proliferar más intensamente, a los efectos de regenerar el tejido dañado.
Y en el caso del cáncer esto no es diferente. A las células tumorales suele eliminárselas prácticamente mediante el tratamiento con radioterapia o quimioterapia; pero, al cabo de algún tiempo, éstas vuelven, y con mayor agresividad aún.
En el marco de un proyecto que cuenta con el apoyo de la FAPESP y con la coordinación de la profesora Sonia Jancar, investigadores del Instituto de Ciencias Biomédicas de la Universidad de São Paulo (ICB-USP), en Brasil, demostraron que una proteína denominada PAFR (receptor del factor activador de plaquetas, por sus siglas en inglés) cumple un papel clave en ese fenómeno de repoblación tumoral, al menos en algunos tipos de cánceres que el grupo ha venido estudiando.
Estos resultados se publicaron en parte recientemente en la revista Oncogenesis, del grupo Springer Nature.
“En experimentos con linajes tumorales y en ratones, observamos que fármacos capaces de bloquear el PAFR inhibieron significativamente el crecimiento de los tumores y el fenómeno de la repoblación tumoral luego de la radioterapia. Por eso sugerimos la asociación de la radioterapia con antagonistas de ese receptor como una nueva y prometedora estrategia terapéutica”, declaró Jancar a Agência FAPESP.
Tal como consignó la investigadora, esta línea de investigación se puso en marcha durante la década de 1990, durante el doctorado de Denise Fecchio, cuando el grupo demostró que tumores inducidos en la cavidad peritoneal de ratones crecían significativamente menos cuando se bloqueaba el PAFR. En ese trabajo, los científicos observaron que el tratamiento con antagonistas del receptor puso en acción a los macrófagos (un tipo de células de defensa) e inhibió el crecimiento del cáncer. Ese trabajo salió publicado en la revista Inflammation.
Algunos años después, durante el doctorado de Soraya Imon de Oliveira –en colaboración con Roger Chammas, docente de la Facultad de Medicina de la USP–, el grupo demostró que en ratones tratados con antagonistas del PAFR el melanoma también crece menos. Y los resultados salieron en BMC Cancer.
Más recientemente, durante el doctorado de Ildefonso Alves da Silva Junior, el grupo comprobó que la activación de ese receptor induce la proliferación de las células tumorales, protegiéndolas de la muerte inducida por la radioterapia. Ese trabajo se realizó bajo la supervisión de profesora del ICB-USP Ana Paula Lepique y contó con la colaboración del equipo de Chammas.
“Da Silva Junior demostró que la irradiación induce la producción de moléculas similares al PAF, que activan el PAFR en la célula tumoral y promueven un aumento de la expresión de ese receptor y la proliferación de las células tumorales. Por ende, dicha activación induce la repoblación tumoral. Este trabajo confirmó –mediante la aplicación de métodos más sensibles– también que los macrófagos existentes en el microambiente del tumor, cuando se los trata con fármacos bloqueadores del PAFR, pasan por una reprogramación que los hace combatir mejor la enfermedad”, comentó Jancar.
Los ensayos preclínicos
Los experimentos que comprobaron la participación del PAFR en el fenómeno de repoblación tumoral se realizaron con linajes de carcinoma de boca (humanos) y de carcinoma de cuello uterino (de ratones), los tipos de cánceres que preferentemente se tratan con radioterapia.
Se dispuso a las células en un medio de cultivo y, luego de que empezaron a crecer, se las irradió simulando un tratamiento radioterapéutico. Inmediatamente después de ese procedimiento, fue posible observar una gran producción de moléculas similares al PAF en los cultivos.
“El PAF es a decir verdad un fosfolípido que se produce fundamentalmente en los procesos inflamatorios y de muerte celular. Como la radioterapia provoca una muerte inflamatoria de las células tumorales, los niveles de PAF aumentan ostensiblemente con este tratamiento”, explicó Da Silva Junior.
Los investigadores trataron entonces una parte de los cultivos con drogas capaces de bloquear el receptor del PAF. Se probaron diferentes moléculas, algunas de ellas que incluso ya se encuentran disponibles en el mercado, pero que nunca se habían empleado contra el cáncer.
Análisis realizados inmediatamente después del tratamiento mostraron que en los linajes expuestos a los antagonistas del PAFR el índice de muerte celular debido a la radioterapia fue hasta un 30% mayor que en los cultivos no tratados. Una nueva verificación realizada nueve días después reveló que en los linajes no tratados, el índice de proliferación celular era mucho mayor, de alrededor de un 50% más que en los cultivos tratados con el bloqueador.
El paso siguiente consistió en inyectar esos linajes tumorales –una vez irradiados– debajo de la piel de ratones para observar el fenómeno de repoblación tumoral in vivo, una situación en la cual se produce una interacción con células inmunológicas y con otros factores. Al cabo de unos 30 días después de las inyecciones, los investigadores medían el volumen del tumor.
“En ese experimento utilizamos dos linajes tumorales genéticamente modificados: uno que sobreexpresa el PAFR y otro sin la expresión de ese receptor. La repoblación tumoral sólo se concretó efectivamente en los animales que recibieron el linaje con sobreexpresión del PAFR”, comentó Da Silva Junior.
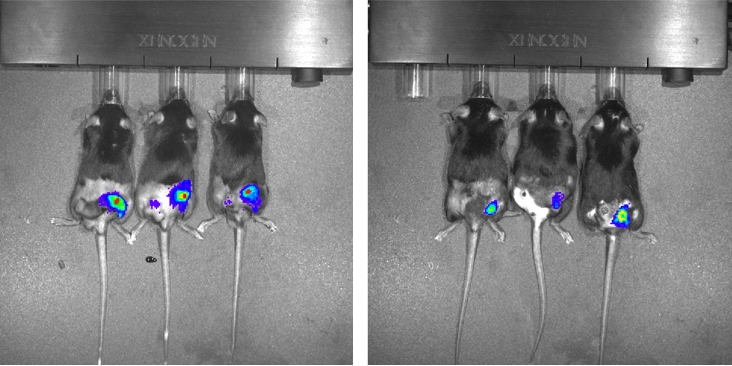
En un tercer experimento, además de las células tumorales, se les aplicaron a los ratones inyecciones con una especie de células de control genéticamente modificadas para expresar una enzima que produce luz, que sirvieron como marcadores dentro de los tumores.
“Las célula de control no fueron irradiadas, pero se las expuso al mismo ambiente y recibieron las señales que los tumores estaban produciendo para estimular la proliferación celular. Mediante una tecnología conocida como IVIS [sistema de imágenes in vivo, por sus siglas en inglés] fue posible medir la proliferación de esas células luminiscentes y calcular el nivel de inducción de la repoblación del tumor producto de la irradiación”, explicó.
Los resultados demostraron que en los animales que recibieron el linaje que sobreexpresa el PAFR, la tasa de proliferación fue 30 veces más alta cuando las células estaban irradiadas en comparación con los que recibieron el mismo linaje pero no irradiado.
Los próximos pasos
Con el objetivo de evaluar si el fenómeno observado no es específico de los linajes tumorales estudiados hasta el momento, el grupo del ICB-USP está replicando los experimentos en otros 10 tipos de tumores humanos. También están haciéndose ensayos en los cuales los antagonistas del PAFR se testean en asociación con medicamentos quimioterapéuticos.
El grupo del ICB-USP está también probando nuevos tipos de inhibidores de PAFR en los linajes tumorales, incluso un grupo de moléculas que aisló de un hongo marino el equipo del profesor Roberto Berlinck, del Instituto de Química de São Carlos (IQSC-USP), en el interior de São Paulo.
“Varias de esas moléculas aparecen como potentes antagonistas del PAFR, capaces de inhibir el fenómeno de repoblación tumoral. Si bien este descubrimiento es relevante, el camino hacia su validación y su uso en ensayos clínicos es largo y requiere de la asociación entre investigadores del área básica, que es nuestro caso, químicos para realizar la síntesis de las moléculas y clínicos para testearlos en personas sanas y en pacientes”, sostuvo Jancar.
Para la investigadora, lo ideal sería rescatar los estudios clínicos con antagonistas del PAFR realizados en la década de 1980 en pacientes con asma y pancreatitis. “Para esas enfermedades los ensayos fueron negativos, pero pueden ser positivos contra el cáncer. Espero que nuestras publicaciones alerten a otros investigadores del área para que puedan dar ese paso. Mientras tanto, estamos estudiando formas de proteger los hallazgos”, dijo Jancar.
Puede leerse el artículo intitulado “Platelet-activating factor (PAF) receptor as a promising target for cancer cell repopulation after radiotherapy” en el siguiente enlace: nature.com/oncsis/journal/v6/n1/full/oncsis201690a.html#aff1.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





