

Estructura en 3D del complejo ribosomal. En azul, las proteínas modificadas por cadenas K63 de ubiquitina identificadas mediante espectrometría de masas cuantitativa (imagen: Silva et al., 2015/ Nature Structural & Molecular Biology)
El estudio salió publicado en la revista Nature Structural & Molecular Biology y puede allanar el camino hacia nuevos tratamientos contra el cáncer y enfermedades neurodegenerativas
El estudio salió publicado en la revista Nature Structural & Molecular Biology y puede allanar el camino hacia nuevos tratamientos contra el cáncer y enfermedades neurodegenerativas
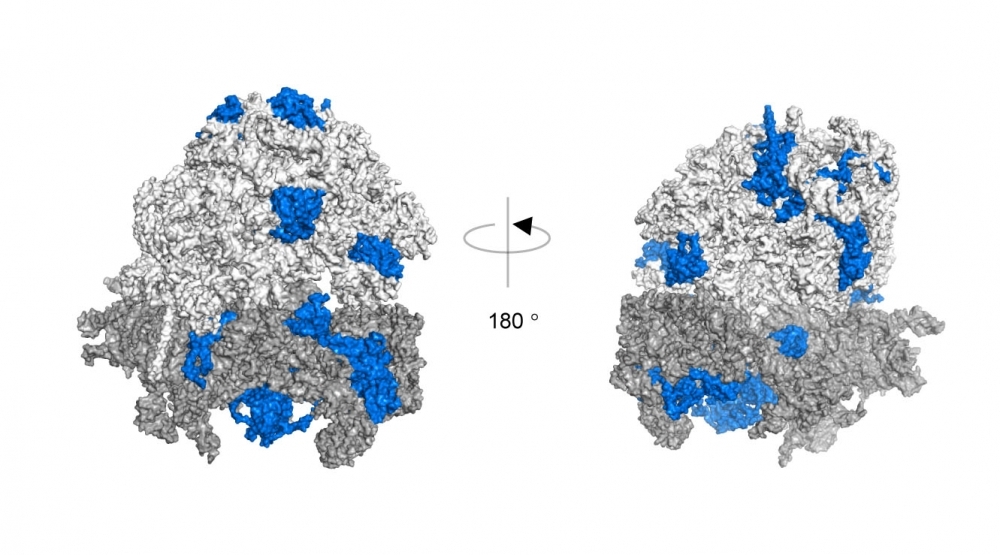
Estructura en 3D del complejo ribosomal. En azul, las proteínas modificadas por cadenas K63 de ubiquitina identificadas mediante espectrometría de masas cuantitativa (imagen: Silva et al., 2015/ Nature Structural & Molecular Biology)
Por Karina Toledo
Agência FAPESP – En un artículo publicado en la revista Nature Structural & Molecular Biology, científicos de la New York University (NYU) y de la Harvard University, ambas instituciones de Estados Unidos, describieron por primera vez un mecanismo que emplean las células para defenderse del estrés oxidativo.
Esta condición biológica se caracteriza por el aumento de los niveles de radicales libres y de otras especies reactivas de oxígeno en el medio celular durante diversos procesos fisiológicos, tales como la inflamación y el envejecimiento. También puede ser producto de la exposición a la contaminación atmosférica, el cigarrillo, la radiación y a productos químicos presentes en alimentos y bebidas.
En exceso, los oxidantes producen daños en los ácidos nucleicos, las proteínas y otras moléculas importantes para el funcionamiento celular. En caso de que este proceso se vuelva crónico, puede derivar en el desarrollo de tumores y de enfermedades neurodegenerativas tales como el Parkinson y el Alzheimer.
“Describimos una nueva vía de señalización celular en respuesta al estrés oxidativo completamente desconocida. Aparte de expandir la comprensión acerca de cómo responden las células ante este tipo de agresión, este descubrimiento puede revelar nuevos blancos terapéuticos que podrán explorarse en el tratamiento de diversas enfermedades”, afirmó Gustavo Monteiro Silva, posdoctorando de la NYU y autor principal del estudio. Son coautores Daniel Finley, de Harvard, y Christine Vogel, de la NYU.
Monteiro Silva inició los estudios en el área cuando todavía estaba cursando su doctorado, en el Instituto de Biociencias de la Universidad de São Paulo (IB-USP), en Brasil, con el apoyo de la FAPESP.
Bajo la coordinación de Luis Eduardo Soares Netto y de Marilene Demasi, él investigó el mecanismo a través del cual el proteasoma –el complejo proteico intracelular– es regulado para degradar proteínas dañadas en una situación de estrés oxidativo (lea más en portugués, en: http://agencia.fapesp.br/15507).
Al término de su doctorado, en colaboración con Vogel, Monteiro Silva se abocó a la proteómica y a la biología de sistemas para entender mejor la respuesta al estrés en el ámbito celular. Los científicos observaron que, aparte de regular la remoción de proteínas dañadas por el proteasoma, la célula puede defenderse controlando la producción de nuevas proteínas claves para la supervivencia al estrés.
Ambos mecanismos de defensa están relacionados con una vía de señalización mediada por una proteína llamada ubiquitina. Esta molécula forma cadenas (poliubiquitina) que se conectan a proteínas blanco, en un proceso conocido como ubiquitinación.
Hasta hace poco tiempo, se creía que la ubiquitinación servía únicamente para señalizarle al proteasoma que una determinada proteína debería ser degradada. Por ese motivo, se le dio el apodo de “el beso de la muerte”.
Sin embargo, estudios más recientes mostraron que las cadenas de poliubiquitina pueden asumir otras funciones de acuerdo con la forma en que las moléculas de ubiquitina se encuentran interconectadas entre sí y organizadas espacialmente.
“La ubiquitinación de proteínas en respuesta al estrés oxidativo es esencial para la célula, pero su papel ha sido debatido por los científicos durante más de 30 años. A sabiendas de que existen distintas cadenas de ubiquitinación, decidí investigar cuál es el tipo, los blancos y la importancia de estas cadenas para la célula en respuesta al estrés oxidativo”, comentó Monteiro Silva.
Los ensayos se realizaron con células de levadura de la especie Saccharomyces cerevisiae. Para inducir el estrés oxidativo, los investigadores inicialmente trataron a las células con peróxido de hidrógeno (agua oxigenada).
Con la ayuda de técnicas de espectrometría de masas y anticuerpos específicos para los dstintos tipos de cadenas, los científicos observaron el esperable aumento de las cadenas de poliubiquitina del tipo K48 (conectadas a través del residuo de aminoácido lisina 48 de la ubiquitina), relacionadas con la degradación de proteínas.
Pero los resultados también mostraron, de manera inédita, el rápido aumento de un tipo de cadena alternativa de poliubiquitina conocida como K63. Esta respuesta se mostró específica para el estrés oxidativo inducido por peróxidos. Cuando estas sustancias oxidantes eran removidas del medio de cultivo, la cantidad de cadenas del tipo K63 disminuía rápidamente, en un proceso sumamente regulado.
“Decidimos entonces investigar la función de esa cadena alternativa K63, y valiéndonos de la proteómica cuantitativa, verificamos que ésta modifica a ciertas proteínas del ribosoma, lo que torna a esta estructura más estable y favorece la síntesis de proteínas importantes para la respuesta antioxidante”, dijo Monteiro Silva.
Blancos terapéuticos
Para que se concrete el proceso de ubiquitinación, es necesario que ocurra una cascada de reacciones catalizadas por diversas enzimas. A juicio de Monteiro Silva, la identificación de las enzimas específicamente implicadas en esa vía hizo posible hallar blancos potenciales para el desarrollo de drogas contra enfermedades relacionadas con el daño oxidativo.
“Observamos que los peróxidos inhiben de manera reversible la acción de una enzima desubiquitinadora llamada Ubp2 (cuya función consiste en remover moléculas de ubiquitina de sus blancos). Por ende, favorecen la acumulación de la cadena K63”, comentó el investigador.
Al realizar experimentos con un linaje de levadura mutante incapaz de formar cadenas K63 de ubiquitina, los investigadores observaron que el daño oxidativo era mayor, la producción de proteínas mermaba y las células mutantes se volvían más sensibles al estrés oxidativo.
“Si logramos entender mejor la función de esas enzimas y de qué manera regula la producción de proteínas esa cadena, podremos intentar modular la respuesta celular al estrés oxidativo, tanto para favorecer la muerte de la célula, en el caso de un tumor, como para tornarla más resistente, lo que sería interesante en el tratamiento de enfermedades neurodegenerativas”, comentó Monteiro Silva.
En este trabajo, el grupo realizó también ensayos con células neuronales de ratones, en las cuales también se observó la formación de cadenas de poliubiquitina K63 en respuesta al estrés. Según Monteiro Silva, el próximo paso consistirá en entender mejor, con base en el conocimiento obtenido con las levaduras, de qué manera actúa ese mecanismo de defensa en células de ratones. En el futuro, el grupo pretende realizar ensayos con linajes humanos.
Suscriptores pueden leer el artículo intitulado K63 polyubiquitination is a new modulator of the oxidative stress response (doi:10.1038/nsmb.2955), publicado por Gustavo Monteiro Silva y otros, en Nature Structural & Molecular Biology, en la siguiente dirección: www.nature.com/nsmb/journal/vaop/ncurrent/full/nsmb.2955.html.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





