
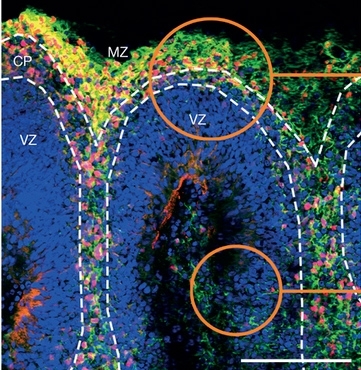
Experimentos con ratones descritos en Nature confirman que el ZIKV atraviesa la barrera placentaria e infecta y destruye células del cerebro en formación. Datos in vitro indican que el linaje brasileño es más agresivo que el original africano (imagen representativa de los organoides cerebrales humanos que muestran la zona marginal (MZ), la placa cortical (CP) y la zona ventricular)
Experimentos con ratones descritos en Nature confirman que el ZIKV atraviesa la barrera placentaria e infecta y destruye células del cerebro. Datos in vitro indican que el linaje brasileño es más agresivo
Experimentos con ratones descritos en Nature confirman que el ZIKV atraviesa la barrera placentaria e infecta y destruye células del cerebro. Datos in vitro indican que el linaje brasileño es más agresivo
Experimentos con ratones descritos en Nature confirman que el ZIKV atraviesa la barrera placentaria e infecta y destruye células del cerebro en formación. Datos in vitro indican que el linaje brasileño es más agresivo que el original africano (imagen representativa de los organoides cerebrales humanos que muestran la zona marginal (MZ), la placa cortical (CP) y la zona ventricular)
Por Karina Toledo | Agência FAPESP – Un estudio realizado en el marco de la Red Zika –que cuenta con el apoyo de la FAPESP– y dado a conocer el pasado 11 de mayo en la revista Nature, presentó la evidencia definitiva de que la infección por el virus del Zika (ZIKV) durante la gestación puede causar malformación cerebral congénita. Se confirma así que esta enfermedad está relacionada con el brote de microcefalia registrado en Brasil en 2015.
Mediante experimentos realizados con ratones, el grupo de la Universidad de São Paulo (USP) demostró que el ZIKV es capaz de atravesar la barrera placentaria e infectar y matar a las células que darían origen al cerebro de los animales en gestación.
Datos de pruebas in vitro sugieren además que el linaje brasileño del virus es más agresivo que el linaje africano, que originariamente infectaba a simios. Esto corrobora la teoría de que en los últimos años el ZIKV habría experimentado mutaciones que lo volvieron más eficiente para infectar humanos (lea más en: http://agencia.fapesp.br/22469).
“No restan más dudas de que el virus del Zika es neurotóxico y puede causar microcefalia. Las lesiones que encontramos en los cerebros de las crías se caracterizan fundamentalmente por la disminución del espesor de la corteza [la capa exterior y la más sofisticada del cerebro de los vertebrados], son sumamente peculiares y también se las halló en los bebés humanos. Asimismo, encontramos al virus replicándose en el cerebro de los ratones recién nacidos en cantidades mucho mayores que en otros órganos”, comentó Jean Pierre Peron, docente del Instituto de Ciencias Biomédicas (ICB) de la USP y uno de los autores del artículo.
Parte de las conclusiones se basa en experimentos realizados con ratones del linaje SJL que, según Peron, parecen constituir un buen modelo para el estudio de la enfermedad. Las hembras fueron infectadas entre el 10º y el 12º día de gestación con un linaje viral aislado en un bebé nacido con microcefalia en el estado de Paraíba, en 2015.
Inmediatamente después del parto, fue posible notar una merma del crecimiento global de las crías expuestas al ZIKV. Mientras que el peso promedio de las crías hembras de control (no infectadas) era de 3,4 gramos al nacer, el peso promedio de las crías infectadas era 1,4 gramos. Las mediciones del cráneo –longitud y altura– presentaron una disminución de al menos un tercio en el grupo expuesto al ZIKV.
Estudios del tejido cerebral realizados en el microscopio mostraron una reducción de la capa cortical, como así también una alteración de la cantidad y en la morfología de las células de esa zona, tal como explicó Patricia Beltrão-Braga, investigadora de la Facultad de Medicina Veterinaria y Zootecnia (FMVZ) de la USP.
“Los análisis histológicos revelaron un fenotipo celular atípico, fundamentalmente en la corteza, pero también en el hipotálamo y en el tálamo. Las células exhibieron lo que denominamos núcleo vacuolado, esto es: la cromatina estaba toda apretada en un rincón del núcleo, que a primera vista parecía estar vacío”, comentó Beltrão-Braga.
Según los investigadores, este fenotipo suele observarse durante procesos que ocasionan la muerte celular. En efecto, análisis de expresión génica realizados posteriormente revelaron que en las crías expuestas al ZIKV, genes asociados con procesos de apoptosis (muerte celular programada) y autofagia (cuando la célula degrada y reabsorbe sus estructuras internas) estaban sobreexpresados en comparación con el grupo de control.
Para complementar los ensayos in vivo, se realizaron pruebas moleculares del tipo de PCR (reacción en cadena de la polimerasa) en tiempo real, capaces de detectar el ARN viral durante la etapa aguda de la infección, en los diversos tejidos de los ratones recién nacidos.
“Encontramos el virus replicándose en el bazo, en el hígado y en los riñones, pero en cantidades mucho menores que las observadas en el cerebro”, dijo Peron.
“El conjunto de resultados muestra que el virus muestra una gran preferencia por las células del sistema nervioso. No sólo detectamos en el cerebro una mayor cantidad de ARN viral, sino también los principales efectos de la infección”, añadió Beltrão-Braga.
Curiosamente, los mismos hallazgos no se observaron en las primeras pruebas realizadas en la USP con ratones del linaje C57BL/6, los que más se utilizan en los laboratorios.
“Este linaje muestra sabidamente una respuesta inmunológica más robusta, con mayor producción de citocinas del tipo interferón alfa y beta. Creemos que esto les ha permitido a esos animales eliminar el virus del organismo de manera más eficaz, impidiendo así su paso a través de la barrera placentaria. Probamos con distintas dosis del virus y en diferentes fechas de infección, y en ningún caso nacieron crías con algún tipo de malformación”, comentó Peron.
Para el investigador, este hecho pone en evidencia la influencia de la genética materna en la extensión del daño que ocasiona el virus al feto. “Al igual que sucede con los ratones, ciertamente debe haber madres humanas más susceptibles al virus y otras más resistentes. Los mecanismos implicados aún deben estudiarse”, ponderó.
Minicerebros
En las pruebas in vitro, se utilizaron tres modelos distintos, desarrollados a partir de células humanas: cultivos bidimensionales (en placa de vidrio) de neuronas y de células neurales progenitoras (un tipo de células madre capaces de diferenciarse en neuronas y en células de la glía), cultivos tridimensionales de células progenitoras neurales (cultivadas en suspensión para formar las llamadas neuroesferas) y organoides cerebrales o minicerebros (estructuras tridimensionales milimétricas creadas en laboratorio a partir de células madre pluripotentes inducidas y capaces de mimetizar el cerebro de fetos durante el primer trimestre de gestación).
En los tres modelos se comparó el efecto de la exposición al linaje brasileño de ZIKV, al linaje africano y también al virus de la fiebre amarilla.
“Decidimos usar el virus de la fiebre amarilla, que también es de la familia Flaviviridae –al igual que virus del Zika y el del dengue–, como una especie de control negativo. Lo hicimos para estar seguros de que los efectos observados no serían producto de cualquier infección viral, sino específicos del Zika”, explicó Beltrão-Braga.
En el experimento realizado con los cultivos bidimensionales, el grupo observó que los tres virus fueron capaces de infectar tanto a las neuronas como a las células progenitoras neurales, pero no se registró muerte celular únicamente en el cultivo expuesto al virus de la fiebre amarilla. Al comparar los dos cultivos infectados con el ZIKV, se notó que las células progenitoras neurales murieron en mucha mayor cantidad que las neuronas.
Según Peron, una de las posibles explicaciones para la mayor susceptibilidad de las células progenitoras neurales puede residir en que éstas expresan en mayor cantidad a una familia de receptores de membrana conocida como TAM. Estudios anteriores indicaron que esos receptores –llamados Tyro3, AXL y MertK– facilitan la entrada de los virus del dengue y del Zika a las células humanas.
En las pruebas realizadas con las neuroesferas, conformadas únicamente por células progenitoras, fue posible detectar claramente en el microscopio el daño ocasionado por el ZIKV, fundamentalmente por el linaje brasileño.
Mientras que las neuroesferas de control (no infectadas) duplicaron su tamaño en el lapso de cuatro días, aquéllas infectadas por el linaje africano crecieron, pero muy poco, lo cual demuestra que hubo muerte celular. En tanto, el tamaño de las neuroesferas infectadas por el virus brasileño disminuyó a menos de un tercio de sus dimensiones iniciales, y éstas exhibieron una estructura desorganizada que evidencia la activación de procesos de muerte celular.
Se observó también que cuanto mayor era la cantidad de virus en el medio, mayor era la destrucción celular. Para Beltrão-Braga, esto puede explicar la ocurrencia de malformaciones con distintos grados de severidad entre los bebés que nacieron con microcefalia en Brasil.
Por último, en los minicerebros infectados con el linaje brasileño, se observó que las muertes se concentraron en las áreas donde estaba produciéndose una mayor neurogénesis (la generación de nuevas neuronas), siendo que algunos subtipos celulares fueron prácticamente exterminados al cabo de cuatro días.
En tanto, los organoides con el virus africano no exhibieron una diferencia significativa con relación a los minicerebros expuestos al virus de la fiebre amarilla. En las áreas ya diferenciadas, tal como la que daría origen a la corteza, las neuronas y las células progenitoras neurales murieron tanto en el caso del virus brasileño como en el del africano.
Para complementar los análisis in vitro, los científicos compararon la infección por el linaje brasileño del ZIKV en minicerebros humanos y en organoides generados a partir de células pluripotentes de chimpancé.
“Los resultados muestran que el linaje brasileño se ha diferenciado tanto respecto al original africano que ya no es capaz de infectar a los organoides de chimpancé, aunque la semejanza entre el genoma humano y el de esos primates sea del 99%. Aparentemente, el ZIKV ha experimentado en el transcurso de los últimos años mutaciones que lo han vuelto más ‘humanizado’ y capaz de causar las malformaciones que estamos viendo en los recién nacidos brasileños”, sostuvo Beltrão-Braga.
Despliegues
A juicio de Peron, al mostrar que ratones del linaje SJL constituyen un buen modelo para el estudio de la infección por el ZIKV, el artículo allana el camino hacia investigaciones orientadas al desarrollo de vacunas y métodos destinados a proteger a los fetos de las madres infectadas.
“En mi laboratorio, el principal interés en este momento reside en entender la biología inherente a esa interacción del virus con los receptores TAN, y por qué eso ocasiona la muerte masiva de las células progenitoras neurales. Pretendemos entender qué vías se activan debido a la interacción del virus con esos receptores”, dijo el investigador del ICB-USP.
Aparte de intentar entender por qué las neuronas se ven menos afectadas que las células progenitoras, Beltrão-Braga también está interesada en descubrir formas de evitar la muerte celular inducida por el virus. “Necesitamos develar cuál es el tipo de respuesta inmunológica que se desencadena en el cerebro y si la misma favorece o minimiza la muerte de las células”, afirmó.
El artículo publicado en Nature contó con la colaboración del coordinador de la Red Zika, Paolo Zanotto (ICB-USP), y de Alysson Muotri, investigador en la Universidad de California en San Diego, Estados Unidos. Los análisis estuvieron a cargo principalmente de Fernanda Cuogola, Isabella Fernandes y Fabiele Russo, estudiantes de posgrado de la FMVZ-USP.
Puede leerse el artículo intitulado The Brazilian Zika virus strain causes birth defects in experimental models (doi:10.1038/nature18296), de Fernanda R. Cugola y otros, publicado en Nature, en el siguiente enlace: www.nature.com/nature/journal/vnfv/ncurrent/full/nature18296.html.
Y pueden verse videos con los investigadores de la USP que participaron en el estudio en: www.youtube.com/playlist?list=PLwA0zWYFcS_g1FxdtBz5OyaiIqdaLpbQv.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





