

Un estudio internacional con participación brasileña apunta a incrementar la capacidad de la PETasa para descomponer el PET, tal como se lo conoce al polímero de las botellas desechables no biodegradables (la PETasa aparece en azul con una cadena de PET –en amarillo– unida a su sitio activo, en donde será degradado/ imagen: Rodrigo Leandro Silveira)
Un estudio internacional con participación brasileña apunta a incrementar la capacidad de la PETasa para descomponer el PET, tal como se lo conoce al polímero de las botellas desechables no biodegradables
Un estudio internacional con participación brasileña apunta a incrementar la capacidad de la PETasa para descomponer el PET, tal como se lo conoce al polímero de las botellas desechables no biodegradables
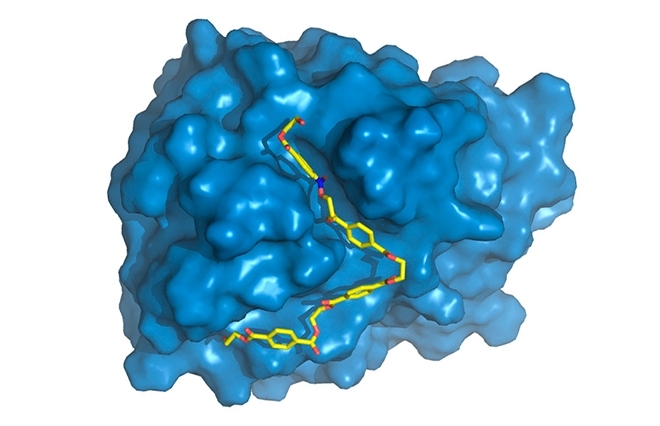
Un estudio internacional con participación brasileña apunta a incrementar la capacidad de la PETasa para descomponer el PET, tal como se lo conoce al polímero de las botellas desechables no biodegradables (la PETasa aparece en azul con una cadena de PET –en amarillo– unida a su sitio activo, en donde será degradado/ imagen: Rodrigo Leandro Silveira)
Por José Tadeu Arantes | Agência FAPESP – Entre 4.800 y 12.700 millones de kilos de plástico se arrojan a los océanos anualmente. De mantenerse la actual tendencia, tal cantidad se decuplicará en 2025. Esto es lo que reveló un estudio publicado en la revista Science en 2015, con datos de 2010.
Uno de los factores que hacen que los plásticos se utilicen tanto es precisamente el que más contribuye para que se erijan como una amenaza contra el medio ambiente: su resistencia a la degradación. Al descartárselas, las botellas PET (de tereftalato de polietileno) pueden perdurar en el medio ambiente durante 800 años.
Debido a todo esto, resulta fácil entender el enorme interés que suscita el descubrimiento de una enzima capaz de digerir el tereftalato de polietileno. Y ahora se ha incrementado la capacidad de degradar el plástico de dicha enzima, denominada PETasa. Esta novedad aparece descrita en un artículo publicado en Proceedings of the National Academy of Sciences of the United States of America (PNAS).
Dos científicos del Instituto de Química de la Universidad de Campinas (IQ-Unicamp), en Brasil, participaron en una investigación realizada en colaboración con pares del Reino Unido (University of Portsmouth) y de Estados Unidos (National Renewable Energy Laboratory). Son ellos el posdoctorando Rodrigo Leandro Silveira y su supervisor, Munir Salomão Skaf, profesor titular y prorrector de Investigación de la Unicamp.
La participación brasileña contó con el apoyo de la FAPESP mediante una Beca de Posdoctorado y una Beca de Pasantía de Investigación en el Exterior concedidas a Silveira, y también por la vía del Centro de Investigación en Ingeniería y Ciencias Computacionales, uno de los Centros de Investigación, Innovación y Difusión (CEPIDs) que la Fundación mantiene y que tiene a Skaf como coordinador.
“El tereftalato de polietileno, utilizado fundamentalmente en la fabricación de botellas de bebidas, es también muy empleado en la confección de ropas, alfombras y otros objetos. En nuestra investigación caracterizamos la estructura tridimensional de la enzima capaz de digerir este plástico, la ingenierizamos para aumentar su poder de degradación y demostramos que tiene actividad también en el polietileno-2,5-furanodicarboxilato (PEF), un sustituto del PET fabricado con base en materias primas renovables”, declaró Silveira a Agência FAPESP.
El interés en la PETasa surgió en 2016, cuando un grupo de científicos japoneses, bajo el liderazgo de Shosuke Yoshida, identificó una nueva especie de bacteria llamada Ideonella sakaiensis, capaz de usar el tereftalato de polietileno como fuente de carbono y energía: en otras palabras, capaz de alimentarse de PET. Se trata hasta ahora del único organismo conocido con tal capacidad. Literalmente crece sobre el PET.
“Aparte de identificar a la Ideonella sakaiensis, los japoneses descubrieron que la misma producía dos enzimas que son secretadas hacia el medio ambiente. Una de las enzimas secretadas era precisamente la PETasa. Como tiene un cierto grado de cristalinidad, el PET es un polímero cuya degradación es sumamente difícil. Técnicamente empleamos el término ‘recalcitrancia’ para designar a la propiedad que poseen ciertos polímeros muy empaquetados de resistir a la degradación. Y el PET es uno de éstos. Pero la PETasa lo ataca y lo descompone en pequeñas unidades de ácido mono(2-hidroxietil)tereftálico (MHET). Las unidades de MHET se convierten entonces en ácido tereftálico y la bacteria las absorbe y las metaboliza”, dijo Silveira.
Todos los seres vivos conocidos utilizan biomoléculas para sobrevivir. Todos menos la Ideonella sakaiensis, que logra utilizar una molécula sintética, fabricada por el ser humano. Esto significa que dicha bacteria es el resultado de un proceso evolutivo muy reciente, acaecido en el transcurso de las últimas décadas: logró adaptarse a un polímero desarrollado a comienzos de la década 1940, y que empezó a utilizarse a escala industrial sólo durante la década de 1970. A tal fin, la PETasa es la pieza clave.
“La PETasa se encarga de la parte más difícil, que consiste en romper la estructura cristalina y despolimerizar el PET en MHET. En tanto, el trabajo de la segunda enzima, que transforma MHET en ácido tereftálico, es bastante más sencillo, toda vez que su sustrato está conformado por monómeros a los cuales la enzima tiene fácil acceso porque se encuentran dispersos en el medio reaccional. Por eso los estudios se concentraron en la PETasa”, dijo Silveira.
La etapa siguiente consistió en estudiar en detalle a la PETasa: éste fue el aporte de la nueva investigación. “Nos enfocamos en descubrir qué era lo que dotaba a la PETasa de la capacidad de hacer algo que las demás enzimas no eran capaces de realizar con demasiada eficiencia. Para ello el primer paso consistió en obtener la estructura tridimensional de esa proteína”, dijo.
“La obtención de la estructura tridimensional implica descubrir las coordenadas x, y y z de cada uno de los miles de átomos que constituyen la macromolécula. Nuestros colegas británicos llevaron a cabo este trabajo aplicando una técnica bastante conocida y utilizada, llamada difracción de rayos X. Trabajaron en un laboratorio muy parecido al Sirius, que está construyéndose en Campinas”, explicó.
La enzima modificada se une mejor al polímero
Una vez obtenida la estructura tridimensional, los científicos empezaron a comparar a la PETasa con proteínas emparentadas. La más parecida es una cutinasa de la bacteria Thermobifida fusca, que degrada a la cutina, una especie de barniz natural que recubre las hojas de las plantas. Ciertos microorganismos patogénicos utilizan cutinasas para romper la barrera de cutina y apropiarse de los nutrientes presentes en las hojas.
“Verificamos que en la zona de la enzima donde se producen las reacciones químicas, el llamado ‘sitio activo’, la PETasa exhibía algunas diferencias con relación a la cutinasa. Posee un sitio activo más abierto. Mediante simulaciones computacionales –y ésta fue la parte en la que más contribuí–, pudimos estudiar los movimientos moleculares de la enzima. Mientras que la estructura cristalográfica –obtenida mediante difracción de rayos X– suministra información estática, las simulaciones permiten recabar información dinámica y descubrir el papel específico de cada aminoácido en el proceso de degradación del PET”, explicó el investigador del IQ-Unicamp.
La física de los movimientos de la molécula es el resultado de las atracciones y repulsiones electrostáticas del enorme conjunto de átomos y de la temperatura. Las simulaciones computacionales permitieron entender mejor de qué manera se une la PETasa con el PET e interactúa con éste.
“Descubrimos que la PETasa y la cutinasa tienen dos aminoácidos distintos en el sitio activo. Mediante la aplicación de procedimientos de biología molecular produjimos entonces mutaciones en la PETasa, con el objetivo de transformarla en cutinasa”, dijo Silveira.
“De lograr hacerlo, demostraríamos por qué la PETasa es PETasa, es decir, sabríamos cuáles son los componentes que la dotan de esa propiedad tan peculiar de degradar el PET. Pero, para nuestra sorpresa, al intentar suprimir la actividad peculiar de la PETasa, es decir, al intentar transformar la PETasa en cutinasa, produjimos una PETasa más activa aún. Procurábamos reducir su actividad, y en lugar de ello la aumentamos”, añadió.
Esto demandó nuevos estudios computacionales para entender por qué la PETasa mutante era mejor que la PETasa original. Mediante el modelado y las simulaciones fue posible percibir que las alteraciones producidas en la PETasa favorecen el acoplamiento de la enzima con el sustrato.
La enzima modificada se une mejor al polímero. Este acoplamiento depende de factores geométricos, es decir, del encastre tipo “llave y cerradura” entre ambas moléculas. Pero también de factores termodinámicos, es decir, de las interacciones entre los diversos componentes de la enzima y del polímero. La manera elegante de describir esto consiste en decir que la PETase modificada exhibe “una mayor afinidad” con relación al sustrato.
En términos de una futura aplicación práctica, a los efectos de obtener un ingrediente capaz de degradar toneladas de residuos plásticos, este estudio ha constituido un rotundo éxito. Pero la pregunta referente a qué es lo que hace que una PETasa sea una PETasa sigue careciendo de respuesta.
“La cutinasa posee los aminoácidos a y b. La PETase posee los aminoácidos x e y. Imaginamos que al intercambiar x e y por a y b lograríamos transformar la PETasa en cutinasa. En lugar de ello elaboramos una PETasa mejorada. En otras palabras, no reside en ambos aminoácidos la explicación acerca del comportamiento distinto de las dos enzimas. Es otra cosa”, dijo Silveira.
Evolución en curso
La cutinasa es una enzima antigua, en tanto que la PETasa es una enzima moderna, resultante de la presión evolutiva que le permitió a la Ideonella sakaiensis adaptarse a un medio que contiene tan sólo o fundamentalmente tereftalato de polietileno como fuente de carbono y energía.
Entre las diversas bacterias incapaces de utilizar ese polímero, alguna mutación generó una especie que logró hacerlo. Esa bacteria empezó a reproducirse y crecer mucho más que las otras porque tenía alimento de sobra. Así fue como se desarrolló. Al menos ésa es la explicación que aporta la teoría evolucionista estándar.
“El hecho de que hayamos obtenido una enzima mejor efectuando una pequeña alteración sugiere fuertemente que esa evolución aún no se ha completado. Aún existen nuevas posibilidades evolutivas que deben comprenderse y explorarse con la mira puesta en la obtención de enzimas más eficientes aún. La PETasa mejorada no es el fin del camino. Es tan sólo el comienzo”, dijo Silveira.
Y con la mira puesta entonces en la aplicación, el próximo paso consiste en pasar de la escala de laboratorio a la industrial. Para ello se harán necesarios otros estudios, relacionados con la ingeniería de reactores, la optimización de los procesos y la disminución de costos.
El artículo intitulado Characterization and engineering of a plastic-degrading aromatic polyesterase (doi: https://doi.org/10.1073/pnas.1718804115), de Harry P. Austin, Rodrigo L. Silveira, Munir S. Skaf y otros, está publicado en el siguiente enlace: pnas.org/content/early/2018/04/16/1718804115.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





