

El panel A muestra la distribución normal de CD4 (en verde) y MHC-I (HLA, en rojo) en linfocitos T. El panel B muestra el cambio en la distribución de esas dos proteínas en un linfocito T que también expresa a la proteína Nef del VIH (imagen: Estela A. Pereira y Luis L. P. da Silva/FMRP-USP)
Investigadores muestran de qué manera la molécula Nef logra ‘burlar’ los mecanismos de defensa de las células humanas para permitir el avance del virus. Científicos brasileños comentan los logros en esta área en un artículo publicado en una revista del grupo Nature
Investigadores muestran de qué manera la molécula Nef logra ‘burlar’ los mecanismos de defensa de las células humanas para permitir el avance del virus. Científicos brasileños comentan los logros en esta área en un artículo publicado en una revista del grupo Nature
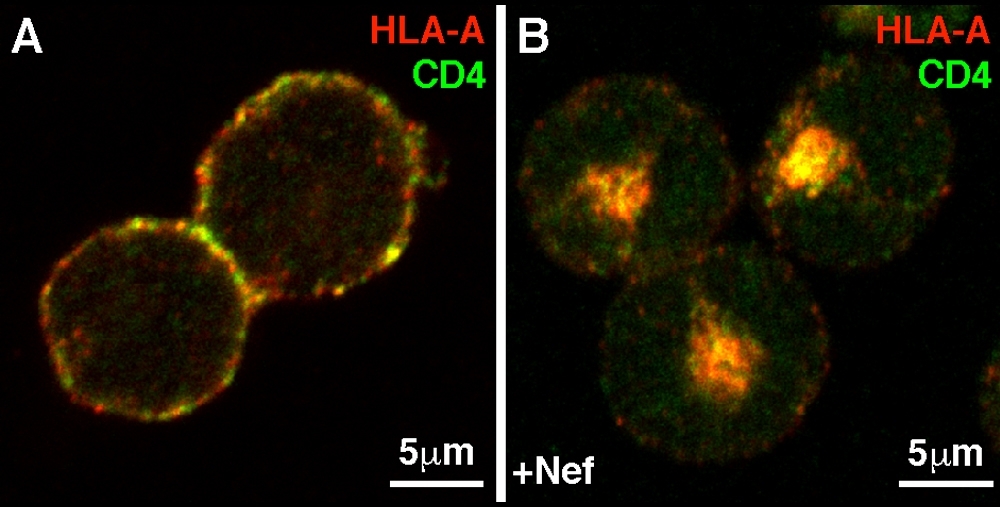
El panel A muestra la distribución normal de CD4 (en verde) y MHC-I (HLA, en rojo) en linfocitos T. El panel B muestra el cambio en la distribución de esas dos proteínas en un linfocito T que también expresa a la proteína Nef del VIH (imagen: Estela A. Pereira y Luis L. P. da Silva/FMRP-USP)
Por Luciana Constantino | Agência FAPESP – El descubrimiento de un potencial “talón de Aquiles” de la proteína Nef, crucial en la virulencia del VIH y en su capacidad de desencadenar el sida, abre caminos en la búsqueda de un nuevo tipo de medicamentos contra este virus. Y científicos han logrado demostrar la existencia de una estructura que une a esta proteína con otra llamada AP-2, cuya función consiste en regular la entrada del mismo a las células.
De este modo, está volviéndose cada vez más clara la manera a través de la cual Nef logra “burlar” los mecanismos de defensa de las células humanas para permitir que el VIH avance y que disminuya el tiempo transcurrido hasta que puedan aparecer los síntomas de la enfermedad.
En un artículo publicado en Nature Structural & Molecular Biology (NSMB), el doctorando Yunan Januário y el profesor Luis Lamberti Pinto da Silva, de la Facultad de Medicina de Ribeirão Preto de la Universidad de São Paulo (FMRP-USP), en Brasil, comentan la importancia de los recientes descubrimientos acerca de esta proteína.
“Investigadores han logrado obtener la estructura tridimensional entre Nef-CD4 y AP-2. De este modo, es posible ver las superficies de contacto, lo que permite la realización de otros estudios que generen una molécula destinada a ocupar ese espacio para impedir la expansión de los efectos de la proteína. Esta ‘fotografía’ habilita la búsqueda de otras terapias contra el VIH”, le explica Lamberti Pinto da Silva a Agência FAPESP.
Con más de 15 años de experiencia en el área, Lamberti Pinto da Silva recibió una invitación de NSMB para comentar un estudio descrito en el artículo intitulado Structural basis of CD4 downregulation by VIH-1 Nef, publicado en la misma edición de la revista y que cuya primera autora es la investigadora Yonghwa Kwon, de la Universidad de Masachusetts (EE. UU.).
“El estudio de Kwon y sus colaboradores muestra notablemente que Nef une directamente CD4 con AP-2. También revela una relación estructural entre la regulación negativa de CD4 mediada por Nef y el antagonismo de Nef al complejo principal de histocompatibilidad I (MHC-I)”, escriben los dos brasileños en su artículo en la NSMB.
Según Lamberti Pinto da Silva, ya se sabe que Nef es fundamental para la progresión de los efectos del VIH en el desarrollo del sida. Asimismo, esta proteína puede seguir produciéndose en el organismo de pacientes en tratamiento o cuyos niveles de virus se mantengan por debajo de lo detectable. "Esto ha venido relacionándoselo con comorbilidades de la infección. Nef es importante y no existe ningún fármaco para atacarla”, añade el profesor.
En el transcurso de los últimos casi 40 años, desde el descubrimiento del virus de la inmunodeficiencia humana como agente etiológico del sida, las investigaciones han develado los intrincados mecanismos a través de los cuales el VIH ataca al sistema inmunológico, invadiendo y controlando a las células. Pero hasta ahora no fue posible bloquear directamente la acción de la Nef, que ya se ha mostrado como una proteína multifuncional y con un intrincado sistema de funcionamiento, que no forma parte de la estructura del VIH, pero que modifica a las células para hacer posible la replicación del virus.
En la actualidad, los medicamentos antirretrovirales, divididos en tipos, actúan en el sistema inmunológico de los pacientes bloqueando las distintas etapas del ciclo de multiplicación del VIH, bajando la carga viral e incluso impidiendo el desarrollo de la enfermedad.
Entre los antirretrovirales más comunes se encuentran los inhibidores de la transcriptasa reversa (nucleósidos y no nucleósidos), por ejemplo, que actúan en esa enzima generando defectos en la cadena de ADN que crea el virus dentro de las células de defensa del organismo o bloqueando directamente su multiplicación. Hay también inhibidores de proteasa y de integrasa (la proteína responsable de la integración del código genético del VIH al de las células humanas), y los denominados inhibidores de entrada, que bloquean receptores como CCR5 e impiden que el VIH penetre en las células de defensa.
Con todo, la creciente resistencia del VIH a los medicamentos actuales y los efectos colaterales en los pacientes han llevado a una búsqueda cada vez más intensa de nuevas formas de combate contra el virus.
El Programa Conjunto de las Naciones Unidas sobre VIH/Sida (ONUSIDA) calcula que alrededor de 38 millones de personas vivían con el virus en el mundo en el año 2019, de las cuales 1,8 millones eran niños de hasta 14 años. Aproximadamente 866 mil brasileños eran portadores del VIH el año pasado, de acuerdo con estimaciones del Ministerio de Salud del país. Del total mundial, el 67% contaba con acceso a la terapia antirretroviral, según ONUSIDA.
Otras conexiones
Lamberti Pinto da Silva publicó al comienzo de este año un estudio con los trabajos de su grupo de investigación en la USP de Ribeirão Preto en el cual se demuestra cómo la Nef se vale de otra proteína celular llamada AP-1G2, y el punto de encuentro entre esas dos vías. Dicha investigación contó con el apoyo de la FAPESP.
Al analizar los efectos de Nef en el sistema de endomembranas de las células hospedantes, el grupo describió los mecanismos mediante los cuales esa proteína se vale de otra llamada AP-1G2 y envía los CD4 a los lisosomas –orgánulos con capacidad para degradar partículas–, retirando así esas moléculas de la superficie celular. Esta acción de Nef facilita la salida de nuevos virus de las células productoras y contribuye para propagar la infección.
Sucede que los CD4 son los receptores que el VIH emplea para entrar a las células. Si estos permanecen sobre la superficie de las células productoras, esos nuevos virus quedan en ellas detenidos y no se propagan tan fácilmente. Por eso la Nef retira a los CD4 de la superficie celular ya infectada.
“Demostramos que existe un punto en común entre esas dos vías. Para enviar CD4 y MHC-I al lisosoma, Nef secuestra a una tercera proteína celular que es común a ambas vías. Ahora, con este resultado, otros grupos pueden demostrar cómo es la estructura de Nef con la tercera proteína. Así será posible obtener un nuevo blanco, como se hizo con AP-2”, añade Lamberti Pinto da Silva.
Actualmente, el grupo de Lamberti Pinto da Silva trabaja en otra investigación, también con el apoyo de la FAPESP, cuyo enfoque reside en descubrir nuevos blancos de Nef. “Varios ingredientes se encuentran disponibles. Ahora es necesario que alguien llegue y cosa todo eso para obtener esa molécula capaz de inhibir la acción de Nef”, culmina el investigador brasileño.
Puede leerse el artículo intitulado Hijacking of endocytosis by VIH-1 Nef is becoming crystal clear, de Yunan C. Januario y Luís Lamberti Pinto da Silva, en el siguiente enlace: www.nature.com/articles/s41594-020-0486-5.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





