

Visualización molecular del receptor de vitamina D, de la conformación de la unión prevista y de la orientación del péptido CSSTRESAC (imagen: Fernanda Staquicini)
Estos tumores, conocidos como triples negativos, muestran un rápido crecimiento y una alta tasa de metástasis. En el marco de un estudio realizado con ratones, se identificó una molécula que se une a un receptor de células de defensa e induce una respuesta inmune antitumoral
Estos tumores, conocidos como triples negativos, muestran un rápido crecimiento y una alta tasa de metástasis. En el marco de un estudio realizado con ratones, se identificó una molécula que se une a un receptor de células de defensa e induce una respuesta inmune antitumoral
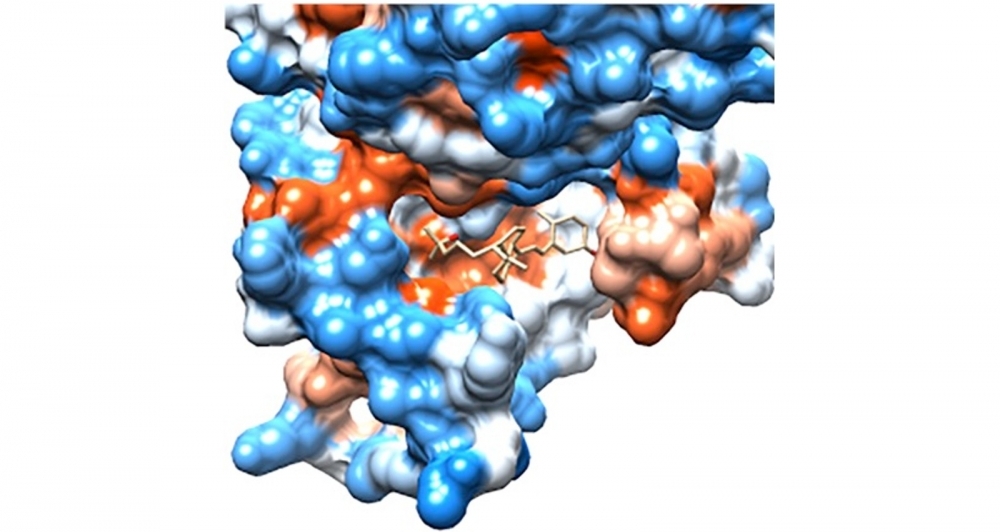
Visualización molecular del receptor de vitamina D, de la conformación de la unión prevista y de la orientación del péptido CSSTRESAC (imagen: Fernanda Staquicini)
Por Luciana Constantino | Agência FAPESP – Una investigación realizada con células de ratones apunta un camino prometedor rumbo a nuevas líneas de estudio enfocadas en el tratamiento del cáncer de mama triple negativo (TNBC, por sus siglas en inglés), un tipo de tumor agresivo y con alta probabilidad de metástasis.
Un grupo de investigadores encabezado por el dúo de brasileños conformado por Renata Pasqualini (bioquímica) y Wadih Arap (científico y oncólogo) identificó un pequeño conjunto de aminoácidos (péptidos con la secuencia CSSTRESAC) capaz de unirse a un receptor alternativo para la vitamina D. Dicho receptor, denominado PDIA3, es hallado en la membrana de macrófagos (importantes células de defensa del organismo) que se infiltran en los tumores de mama triples negativos y provocan inmunosupresión.
De acuerdo con la investigación, la administración sistémica de CSSTRESAC generó una elevada expresión de citoquinas antitumorales y la modulación de la respuesta celular. Juntos, estos dos factores activaron la respuesta inmune y redujeron el crecimiento de los tumores en los ratones. El resultado de este trabajo salió publicado en la revista científica eLife.
“Nuestra estrategia es distinta y seguramente complementaria a los abordajes más convencionales. En lugar de tratar directamente a las células tumorales, utilizamos CSSTRESAC para modular e inducir una respuesta inmune más eficiente. Al combinársela con la cirugía, la quimioterapia y la radioterapia, esta estrategia puede ofrecer una alternativa más robusta al tratamiento de tumores de mama triples negativos, que suelen ser muy agresivos y de difícil control clínico local y sistémico”, afirma Pasqualini, en entrevista concedida a Agência FAPESP.
La investigadora recuerda que estas conclusiones aún se basan en modelos experimentales en ratones, pero afirma que los datos son alentadores. “Todavía queda un camino por recorrerse hasta llegar a los ensayos clínicos de fase I en pacientes humanos. Sin embargo, los resultados publicados son prometedores, lo que justifica el avance de esta línea de investigación con miras al desarrollo de estudios de traducción clínica durante la próxima fase.”
Pasqualini coordina actualmente junto a Arap un laboratorio en la Universidad Rutgers, en Nueva Jersey (Estados Unidos). Este estudio cuenta con una tercera parte de coautores brasileños, incluida la primera autora, Fernanda Iamassaki Staquicini, quien fue becaria de la FAPESP a comienzos del decenio de 2000.
Este trabajo contó también con el apoyo de la FAPESP en el marco de dos proyectos (12/24105-3 y 20/13562-0) coordinados por el profesor Mauro Javier Cortez Véliz, del Departamento de Parasitología del Instituto de Ciencias Biomédicas de la Universidad de São Paulo (ICB-USP), en Brasil.
El panorama
El cáncer de mama es el segundo tipo de tumor en lo que hace a frecuencia en el mundo, con una estimación de aproximadamente 2,3 millones de nuevos casos anuales. Representa casi un 25 % de los cánceres en mujeres y también es la causa más común de muerte causada por esta enfermedad en esa población, con 684 mil decesos estimados al año. El cáncer tipo triple negativo (TNBC) abarca entre el 10 % y el 20 % de los registros de cáncer de mama.
En Brasil, de acuerdo con datos del Instituto Nacional del Cáncer (Inca), excluidos los tumores de piel no-melanoma, el de mama también es el de mayor incidencia en mujeres de todas las regiones del país, con tasas mayores en el sur y en el sudeste. La última estimación nacional de nuevos casos, en 2021, apuntaba 66.280 (43,7 casos cada 100 mil mujeres). Es también la primera causa de muerte por cáncer entre la población femenina brasileña.
Los TNBC son considerados tumores agresivos, generalmente con un tamaño mayor al principio, y de rápido crecimiento, con probabilidades de metástasis. Exhiben también chances mayores de recidiva tras el tratamiento.
Se diagnostican mediante estudios que analizan las células cancerosas: si estas no poseen receptores de estrógeno o progesterona y no producen la proteína HER2, se considera que el cáncer de mama es triple negativo.
La propagación metastásica generalmente se concreta mediante la eliminación de linfocitos (células de defensa) infiltrantes de tumores y la secreción de citoquinas inmunoinhibitorias, fundamentalmente los macrófagos asociados al cáncer. Debido a esta mayor cantidad de linfocitos infiltrantes, los TNBC son más propensos a responder a la inmunoterapia, lo cual llevó los científicos a investigar las funciones inmunorreguladoras mediadas por el péptido CSSTRESAC.
Una nueva técnica
En la investigación, el grupo aplicó la tecnología de exhibición de fago in vivo para aislar péptidos encontrados en los tumores como una estrategia tendiente a descubrir blancos no malignos. Esta técnica captura proteínas o fracciones de las mismas que interactúan con moléculas blanco.
De este modo, identificaron el péptido cíclico (CSSTRESAC) que se une específicamente al receptor de vitamina D, la proteína disulfuro isomerasa A3 (PDIA3), expresada en la superficie de los macrófagos asociados al tumor.
“La administración sistémica de CSSTRESAC en ratones con TNBC alteró el perfil de citoquinas en dirección hacia una respuesta inmune antitumoral y retardó el crecimiento del tumor. Asimismo, el CSSTRESAC hizo posible la entrega teranóstica orientada al ligando para tumores. Un modelo matemático confirmó nuestros hallazgos experimentales”, culminan diciendo los científicos en el artículo.
Teranóstico es un nuevo concepto que está utilizándose en la medicina nuclear para el tratamiento del cáncer, y transforma simultáneamente en herramienta de diagnóstico y de tratamiento a los radiofármacos aplicados directamente en tumores.
“Nuestro próximo objetivo consiste en evaluar la integración de esta estrategia con otras terapias ya aprobadas y en uso para el tratamiento del cáncer de mama triple negativo. La radioterapia, por ejemplo, es efectiva a corto plazo, pero aún frustra pues a menudo se producen recidivas de los tumores localmente o en metástasis en otros órganos. En tal sentido, la combinación de la radioterapia con nuestros péptidos tiene chances de mejorar el pronóstico de las pacientes con el control local del tumor”, explica Staquicini.
La colaboración del grupo se puso en marcha hace algunos años e incluye un trabajo desarrollado en el ICB-USP que apuntó de qué manera Leishmania explota vías de señalización de receptores tipo Toll endosomales vía TLR9 (responsable del reconocimiento del ADN no metilado de patógenos tales como bacterias, virus y parásitos) para inhibir la función microbicida de macrófagos, favoreciendo así su proliferación intracelular en el hospedante. Ese artículo se publicó en 2019 en el The Journal of Clinical Investigation Insight.
Actualmente, el laboratorio dirigido por Pasqualini y Arap es reconocido internacionalmente por sus aportes en las áreas de biología vascular, de mecanismos de progresión en diversos tipos de cánceres y de desarrollo de abordajes terapéuticos innovadores. En este aspecto, llama la atención el potencial demostrado de la relevancia clínica de moléculas con efecto terapéutico dirigidas a las células blanco, aumentando la actividad biológica y disminuyendo los efectos colaterales.
La capacidad de mapear marcadores moleculares, dentro del concepto de “códigos postales” en vasos sanguíneos del cuerpo humano, fue perfeccionándose en el transcurso de dos décadas en el seno del grupo y con el trabajo de científicos de otros centros de estudio. Estos “códigos” constituyen una tecnología de mapeo de las moléculas que proporciona la orientación de los medicamentos exclusivamente hacia las células blanco del organismo.
Es una analogía con el código postal: la ciencia encuentra la “dirección exacta” de las células enfermas, fundamentalmente tumores, y envía una “encomienda” capaz de eliminar específicamente a la enfermedad, sin afectar al vecindario.
Puede leerse el artículo intitulado Targeting a cell surface vitamin D receptor on tumor-associated macrophages in triple-negative breast cancer en el siguiente enlace: elifesciences.org/articles/65145.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





