

Una investigación describe una nueva vía de agregación de la proteína superóxido dismutasa, que puede estar implicada en el mecanismo de la esclerosis lateral amiotrófica (vista esquemática de la ruta revelada para la agregación de la proteína superóxido dismutasa/ imagen: ASBMB)
Una investigación describe una nueva vía de agregación de la proteína superóxido dismutasa, que puede estar implicada en el mecanismo de la esclerosis lateral amiotrófica
Una investigación describe una nueva vía de agregación de la proteína superóxido dismutasa, que puede estar implicada en el mecanismo de la esclerosis lateral amiotrófica
Una investigación describe una nueva vía de agregación de la proteína superóxido dismutasa, que puede estar implicada en el mecanismo de la esclerosis lateral amiotrófica (vista esquemática de la ruta revelada para la agregación de la proteína superóxido dismutasa/ imagen: ASBMB)
Por Karina Toledo
Agência FAPESP – La ciencia aún no comprende bien todos los factores que llevan al desarrollo de la esclerosis lateral amiotrófica (ELA), una enfermedad progresiva y fatal caracterizada por la degeneración de las neuronas motoras. Sin embargo, datos de la literatura científica indican que el proceso de agregación de una proteína conocida como superóxido dismutasa desempeña un papel clave en el mecanismo patológico.
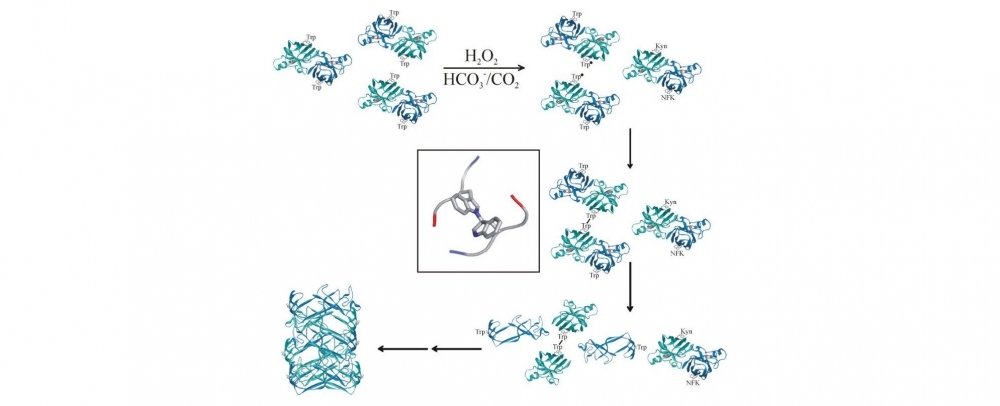
En un artículo publicado recientemente en The Journal of Biological Chemistry, científicos de la Universidad de São Paulo (USP) describieron una nueva vía de agregación de la proteína superóxido dismutasa relacionada con la oxidación de uno de sus residuos de aminoácido: el triptofano 32.
Este descubrimiento puede allanar el camino hacia el desarrollo de nuevas drogas contra la ELA, una enfermedad rara (1 caso cada 100 mil personas por año), cuyo portador más conocido quizá sea el científico Stephen Hawking, de la University of Cambridge, en el Reino Unido.
“La superóxido dismutasa es una de las principales defensas antioxidantes del organismo humano. Su función primordial consiste neutralizar un radical libre de oxígeno conocido como anión superóxido, que en exceso, puede ser tóxico para las células”, explicó Ohara Augusto, docente del Instituto de Química de la USP y coordinadora del Centro de Investigación de Procesos Redox en Biomedicina (Redoxoma), uno de los Centros de Investigación, Innovación y Difusión (CEPIDs) de la FAPESP.
De acuerdo con la investigadora, estudios anteriores mostraron que en la médula de portadores de ELA y en la de modelos animales de la enfermedad es posible hallar agregados de superóxido dismutasa, como así también daños oxidativos en proteínas, lípidos y moléculas de ADN.
“El daño oxidativo existe, eso sin lugar a dudas, pero no sabemos con claridad si es la causa o una consecuencia de la enfermedad”, dijo Augusto. También de acuerdo con la literatura científica, en alrededor del 10% de los casos la ELA es hereditaria, y en un 20% de ellos es posible hallar mutaciones en el gen de la superóxido dismutasa. No obstante, el otro 90% corresponde a los que se consideran como casos esporádicos, con etiología desconocida.
“Mutaciones en la enzima aisladamente no explican la enfermedad, pero, como los síntomas y la evolución de la forma familiar y esporádica de ELA son similares, se presume entonces un mismo mecanismo patogénico para ambas. Modificaciones oxidativas en la superóxido dismutasa podrían explicar los cambios estructurales que llevarían a la agregación proteica”, dijo Augusto.
Alteración estructural
Algunas modificaciones oxidativas en la enzima relacionadas con la ELA ya habían sido descritas por otros grupos, pero el trabajo de los investigadores del Redoxoma fue el primero en describir una vía que involucra a la oxidación del triptofano 32, un aminoácido encontrado en la superóxido dismutasa de humanos y simios, pero no en la de otros mamíferos.
Coincidentemente o no, la ELA es una enfermedad descrita por los científicos casi que exclusivamente en simios, lo que sugiere que la oxidación del triptofano 32 está de alguna manera involucrada en el mecanismo patológico.
“Para inducir la enfermedad en roedores, por ejemplo, fue necesario engendrar animales transgénicos, capaces de expresar la enzima humana”, comentó la investigadora.
En un trabajo anterior, Augusto había descrito que, en determinadas situaciones, la enzima superóxido dismutasa puede desempeñar una actividad prooxidante y, en dichos casos, puede formar un radical carbonato. En experimentos in vitro, la investigadora mostró que ese radical carbonato es el encargado de oxidar al aminoácido triptofano 32.
“Al ser oxidado, ese triptofano 32 se une a otra molécula de la enzima –un radical triptofanilo– y forma un tetrámero (una molécula composta por cuatro unidades). Demostramos mediante técnicas espectroscópicas que eso lleva a la enzima a desenmarañarse (a perder la forma funcional) y a agregarse”, comentó Augusto.
Paso por paso
Para realizar el experimento, los científicos usaron enzimas humanas recombinantes, es decir, producidas en laboratorio utilizando bacterias genéticamente modificadas para expresar el gen de la superóxido dismutasa.
Se utilizaron tanto la enzima normal (wild type) como una de las formas mutantes asociadas a la ELA conocida como G93A. Para estimular la actividad prooxidante, los investigadores incubaron las dos versiones de la enzima con agua oxigenada y bicarbonato.
“La enzima se vale del agua oxigenada para oxidar otras moléculas: en este caso, es la propia enzima, que queda inactiva. En tanto, el bicarbonato se empleó por hacer las veces de corrector fisiológico por excelencia, es decir, es una sustancia hallada en todos los fluidos del organismo humano y actúa como corrector de pH”, explicó Augusto.
Los investigadores hicieron un seguimiento del proceso de oxidación de las dos formas de la enzima –la normal y la mutante– en distintos intervalos de tiempo, durante una semana. Todas las modificaciones ocurridas en la estructura de la proteína en los diferentes momentos analizados se describieron con ayuda de técnicas de espectrometría de masa.
“Observamos que al cabo de una hora de oxidación empieza a formarse un tetrámero de 10 nanómetros (nm) de diámetro, que permanece hasta 48 horas, y después empiezan a formarse los agregados proteicos que llegan a 800 nm de diámetro”, comentó la investigadora.
De acuerdo con Augusto, el proceso de agregación de la mutante G93A fue un poco más acelerado que el de la enzima normal, pero la diferencia no fue significativa estadísticamente.
En uno de los experimentos realizados, los científicos cambiaron el aminoácido triptofano 32 por una fenilalanina y, si bien la enzima adquirió actividad oxidativa en presencia de agua oxigenada, la agregación proteica no se concretó.
“Ese resultado demuestra que efectivamente es necesario que esté presente el triptofano 32 oxidado para que se concrete la agregación. Es algo que ya había sido propuesto en estudios anteriores, pero nunca había sido examinado en la práctica”, comentó Augusto.
A juicio de la científica, en caso de que nuevos estudios comprueben que también in vivo puede ocurrir la formación del radical carbonato y la consiguiente oxidación del triptofano, y que eso puede derivar en la agregación proteica, entonces ese aminoácido podrá convertirse en un blanco terapéutico.
“Una de las posibilidades sería desarrollar un anticuerpo capaz de reconocer al ditriptofano, que es el producto de la oxidación del triptofano 32, e impedir que las proteínas se agreguen”, afirmó Augusto.
Puede leerse el artículo intitulado Oxidation of the tryptophan 32 residue of human superoxide dismutasa 1 caused by its bicarbonate-dependent peroxidase activity triggers the non-amyloid aggregation of the enzyme (doi: 10.1074/jbc.M114.586370 jbc.M114.586370) en la siguiente dirección electrónica: www.jbc.org/content/early/2014/09/18/jbc.M114.586370.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





