

Las células tumorales experimentan una exacerbación de su metabolismo, aquí ejemplificado mediante localización de la glutaminasa C en la extensa red de mitocondrias (en verde). Las mitocondrias constituyen los hornos que generan la energía de las células. En azul, los núcleos celulares (crédito: LNBio/ CNPEM)
En un artículo publicado en Molecular Cell, científicos describen los mecanismos moleculares que regulan la expresión de la glutaminasa C
En un artículo publicado en Molecular Cell, científicos describen los mecanismos moleculares que regulan la expresión de la glutaminasa C
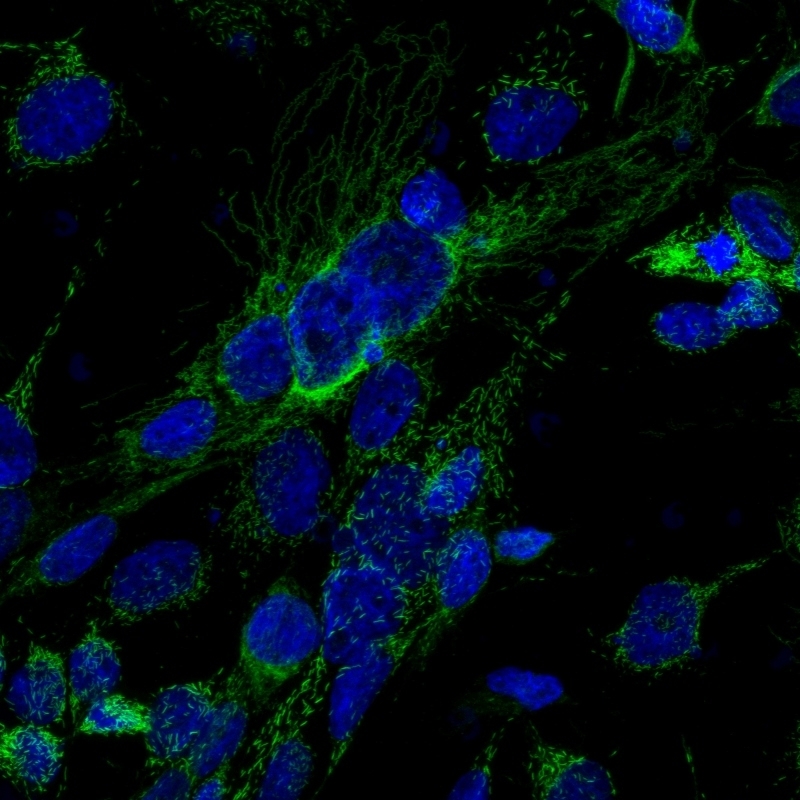
Las células tumorales experimentan una exacerbación de su metabolismo, aquí ejemplificado mediante localización de la glutaminasa C en la extensa red de mitocondrias (en verde). Las mitocondrias constituyen los hornos que generan la energía de las células. En azul, los núcleos celulares (crédito: LNBio/ CNPEM)
Por Karina Toledo | Agência FAPESP – En un artículo publicado en la revista Molecular Cell, investigadores del Laboratorio Nacional de Biociencias (LNBio), en Brasil, describieron los mecanismos moleculares que regulan la producción de la enzima glutaminasa C (GAC), importante en la metabolización de un “combustible” esencial para la rápida proliferación de las células tumorales.
Según los autores, este descubrimiento puede allanar el camino hacia el desarrollo de nuevos tratamientos contra el cáncer.
El estudio estuvo a cargo del Grupo de Investigaciones del Metabolismo Tumoral del LNBio, en colaboración con científicos del MD Anderson Cancer Institute, de la Universidad de Texas, en Estados Unidos. Este trabajo contó con el apoyo de la FAPESP a través de Ayudas Regulares concedidas a Sandra Dias y Andre Ambrosio, además de una Beca Doctoral concedida a Douglas Meira.
“La enzima glutaminasa cumple la función de convertir al aminoácido glutamina en glutamato. Esta reacción química les permite a las células valerse de la glutamina como combustible, así como lo hacen con la glucosa, para la producción de energía y la síntesis de aminoácidos, ácidos nucleicos y otras macromoléculas importantes en su funcionamiento. Como las células tumorales proliferan en forma descontrolada, deben duplicar su biomasa constantemente. Para ello, resulta esencial el consumo de glutamina”, explicó Ambrosio.
De acuerdo con el investigador, pueden hallarse diversas isoformas de la enzima glutaminasa en el organismo humano, y las más conocidas son la GAC, la KGA (kidney-type glutaminase) y a LGA (liver-type glutaminase). Si bien exhiben pequeñas diferencias en sus cadenas de aminoácidos, todas catalizan la misma reacción química.
“Datos disponibles en la literatura indican que la isoforma LGA cumple un papel en la transmisión de estímulos nerviosos en el cerebro, así como la KGA es importante en la detoxificación de amoníaco en los riñones. En tanto, la isoforma GAC está relacionada más bien con el crecimiento de tumores y, por ende, la comprensión de su expresión tiene impacto directo en las terapias”, afirmó Dias.
El descubrimiento de que la isoforma GAC es la más importante para suplir las necesidades metabólicas de las células cancerosas lo realizó el Grupo de Investigaciones en Metabolismo Tumoral del LNBio, y salió publicado en la revista Proceedings of the National Academy of Sciences of the United States of America (PNAS) en 2012.
“En ese trabajo anterior, demostramos que la GAC tiene una actividad catalítica mucho más relevante que las demás isoformas y, asimismo, su expresión se encuentra incrementada en las células tumorales. Pero todavía no se entendían las razones de dicho aumento, es decir, qué efecto de reprogramación estaría favoreciendo la sobreexpresión de esa enzima en el cáncer”, comentó Ambrosio.
Tras la divulgación del trabajo en PNAS, el grupo del LNBio recibió la consulta del médico genetista George Calin, del MD Anderson Cancer Institute, que se venía dedicando a investigar mecanismos moleculares implicados en el desarrollo de cáncer colorrectal.
Calin había descubierto que en este tipo de tumores era común la sobreexpresión de un ARN no codificante (que no contiene información para la síntesis de proteínas) conocido como CCAT2.
“Había observado, más específicamente, que una variante alélica de CCAT2, con una base guanina (G) en lugar de una timina (T), estaba relacionada con el riesgo incrementado de cáncer colorrectal. Calin notó también que el cambio de ese nucleótido generaba alteraciones metabólicas en las células y planteó la hipótesis de que ese ARN no codificante sería un regulador de glutaminasa. Y nos consultó por eso”, comentó Dias.
Una colaboración con siete países
Ese encuentro redundó en una colaboración en la cual participaron científicos de siete países: Brasil, Estados Unidos, España, Holanda, Croacia, Italia y Rumania. El grupo, supervisado por Calin y Dias, demostró mediante la aplicación de diversas técnicas que el ARN CCAT2 con la variante alélica interactúa más a menudo con un complejo proteico conocido como CFIm.
“Estas proteínas del complejo CFIm actúan en el ARN transcrito por el gen que codifica las glutaminasas GAC y KGA, y son capaces de definir, mediante un proceso al que denominamos splicing alternativo, cuál de las dos isoformas producirán las células”, explicó Dias.
Por ende, según la investigadora, los datos del trabajo comprobaron que la variante alélica de CCAT2 induce un aumento en la expresión de GAC en detrimento de la isoforma KGA, lo cual favorece un mayor consumo de glutamina por parte de las células tumorales y deriva en un aumento de la proliferación celular y de la metástasis.
“Con base en este conocimiento, es posible pensar en formas de inhibir la expresión de la isoforma GAC, pues en diversos estudios ha quedado demostrado que ésta constituye un blanco prometedor. Ya existe un compuesto en ensayos clínicos fase I para distintos tipos tumorales”, comentó Dias.
Puede leerse el artículo intitulado Allele-Specific Reprogramming of Cancer Metabolism by the Long Non-coding ARN CCAT2 (doi: 10.1016/j.molcel.2016.01.015) en el siguiente enlace: sciencedirect.com/science/article/pii/S1097276516000162.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





