

Imágenes de microscopía muestran la diferencia de espesor de la capa vascular de la retina de los siguientes grupos (en sentido horario): animales sin retinopatía, animales con retinopatía inducida tratados con el péptido, animales con retinopatía tratados con placebo y animales con retinopatía sin tratamiento (imagen: Science Advances)
La molécula, descrita en la revista Science Advances, mostró capacidad para inhibir el crecimiento patológico de nuevos vasos sanguíneos en estudios preclínicos
La molécula, descrita en la revista Science Advances, mostró capacidad para inhibir el crecimiento patológico de nuevos vasos sanguíneos en estudios preclínicos
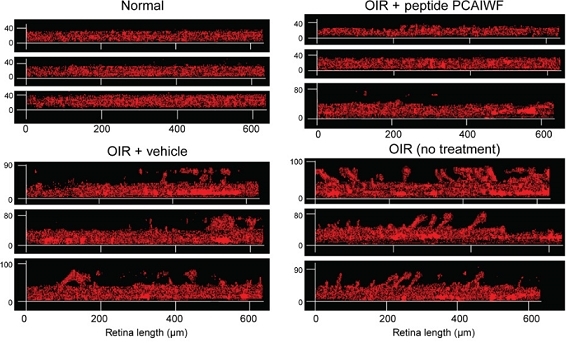
Imágenes de microscopía muestran la diferencia de espesor de la capa vascular de la retina de los siguientes grupos (en sentido horario): animales sin retinopatía, animales con retinopatía inducida tratados con el péptido, animales con retinopatía tratados con placebo y animales con retinopatía sin tratamiento (imagen: Science Advances)
Por Karina Toledo | Agência FAPESP – Un pequeño péptido sintético identificado por científicos del Instituto de Química de la Universidad de São Paulo (IQ-USP), en Brasil, mostró en estudios preclínicos potencial para inhibir el crecimiento patológico de nuevos vasos sanguíneos, un proceso que ocurre en enfermedades tales como la retinopatía y el cáncer.
La investigación se llevó a cabo durante el posdoctorado de Jussara Michaloski Souza, bajo la coordinación del profesor Ricardo Jose Giordano. El proyecto contó con el apoyo de la FAPESP y sus resultados se dieron a conocer recientemente en la revista Science Advances.
“El péptido aún no es un fármaco, pero puede servir de modelo para el desarrollo de un nuevo inhibidor de la angiogénesis”, dijo Giordano en entrevista concedida a Agência FAPESP.
Tal como explicó el investigador, la angiogénesis es el proceso de formación de nuevos vasos sanguíneos con base en otros ya existentes. El mismo puede ocurrir de manera fisiológica, durante la cicatrización, o cuando se produce un aumento de la demanda de oxígeno y de nutrientes en un determinado tejido.
Con todo, en el caso de la retinopatía diabética, por ejemplo, el exceso de glucosa en la sangre induce un desarrollo exagerado y desorganizado de los vasos de la retina: provoca lesiones en el tejido y puede comprometer la visión. Y en algunos tipos de cáncer, el tumor libera mediadores que inducen una intensa angiogénesis a los efectos de incrementar el aporte de oxígeno y de nutrientes, de modo tal que las células malignas puedan seguir proliferando descontroladamente.
Los principales mediadores implicados en el proceso de angiogénesis son cuatro proteínas de la familia VEGF (factor de crecimiento endotelial vascular, por sus siglas en inglés): VEGFA, B, C y D. Las mismas deben unirse a receptores específicos existentes en la superficie de las células –las proteínas VEGFR-1, 2 y 3– para que se dispare una cascada de señalización intracelular y comience así el proceso de formación de los nuevos vasos.
“El péptido que describimos en el estudio, cuya secuencia de aminoácidos es PCAIWF, se mostró capaz de unirse a los tres receptores de VEGF en la superficie de la célula, bloqueando la acción de toda la familia de proteínas”, comentó el investigador.
Descubrimiento
Para hallar la molécula que interactuaba mejor con la parte extracelular de los receptores, el grupo que coordina Giordano desarrolló y seleccionó una biblioteca con casi 10 mil millones de péptidos distintos. Para ello se empleó una técnica conocida como Phage Display.
Este método consiste en manipular el genoma de bacteriófagos (virus que infectan bacterias) para hacer que cada partícula viral sintetice un péptido distinto, que se adhiere a su proteína de superficie.
“Utilizamos bacteriófagos porque son virus sumamente resistentes a las variaciones de temperatura y de pH. De este modo, las bibliotecas de péptidos que se generan siguen siendo viables para la investigación durante años”, comentó Giordano.
El siguiente paso consistió en incubar toda la biblioteca con un receptor de VEGFR para ver qué partículas virales se adherirían a esta proteína. “De entrada nos enfocamos únicamente en el VEGFR-3, que era el menos estudiado hasta ese momento en lo que se refiere a la angiogénesis. La idea era hallar un péptido que se uniese a ese receptor para descubrir qué sucedería si el mismo fuese bloqueado”, comentó Giordano.
Las primeras pruebas indicaron que el péptido PCAIWF es el más prometedor. Al realizar nuevos test in vitro con la molécula purificada (ya no acoplada al bacteriófago), los investigadores descubrieron que la misma también se unía al VEGFR-1 y 2, bloqueando la acción de toda la familia VEGF.
“Cada una de las proteínas se une a receptores distintos. El VEGFA, por ejemplo, se une al VEGFR-1 y 2, pero no se une al VEGFR-3. En tanto, el VEGFC se une al VEGFR-2 y 3, pero no así al VEGFR-1. Por ende, al bloquear los tres receptores inhibimos la acción de todas las proteínas de esa clase, lo que sugiere una acción más eficaz”, explicó Giordano.
Pruebas in vivo
Para testear este efecto in vivo, los científicos emplearon un modelo de ratón que simula la retinopatía de la prematuridad. En bebés humanos, esta condición es provocada por la exposición excesiva al oxígeno en las incubadoras neonatales. El gas inhibe la formación de los vasos de la retina, que normalmente ocurre durante las últimas semanas de gestación. Cuando el bebé sale de la incubadora, el tejido ocular sufre hipoxia (falta de oxígeno) y se produce una angiogénesis patológica.
“El bebé ratón nace con sus ojos cerrados, que recién se abren al 14º día de vida aproximadamente. Por ende, el proceso de formación de los vasos de la retina ocurre luego del nacimiento en esos roedores, y así podemos simular el proceso que acomete a los bebés prematuros”, explicó Giordano.
A los siete días de vida, los ratones fueron dispuestos en una cámara de oxígeno, y allí permanecieron hasta el 12º día. Al 15º día, a algunos de los animales se les aplicó una inyección intraocular con el péptido PCAIWF. Y se los analizó dos días después, cuando se concretaría el apogeo del proceso de angiogénesis.
Mientras que en los animales a los que se les administró únicamente placebo los signos de retinopatía se hacían evidentes, en el grupo tratado con el péptido el área vascular y la profundidad de la vasculatura se encontraban en condiciones similares a las de los roedores que no pasaron por la cámara de oxígeno; por ende, exhibían un desarrollo normal de la retina.
Los nuevos pasos
Según Giordano, los resultados obtenidos durante el posdoctorado de Michaloski Souza abrieron nuevos frentes de investigación. Uno de éstos, ya en marcha, es el estudio en profundidad de la estructura del péptido, con métodos tales como la resonancia magnética nuclear, para entender de qué manera interactúa con los receptores.
“Este conocimiento abre el camino rumbo al diseño racional de nuevos inhibidores de la angiogénesis, que quizá puedan administrarse por vía oral. Sin embargo, y pese a que el péptido no es la droga ideal, dado que debe inyectárselo directamente en el ojo, cosa que no es precisamente agradable, quizá sea posible desarrollar nanofórmulas de liberación más lenta. De este modo sería posible espaciar más las inyecciones”, dijo Giordano.
Actualmente existe en el mercado el biofármaco inyectable bevacizumab, que actúa neutralizando la acción del VEGFA. “Se trata de un anticuerpo monoclonal que neutraliza la acción de la proteína más importante en el proceso de angiogénesis, y ha sido utilizado para tumores de colon y riñón, gliomas y también en el tratamiento de la retinopatía. Pero es un medicamento caro. Cuesta alrededor de cinco mil reales la dosis y son necesarias inyecciones mensuales”, comentó Giordano.
Otra opción es el fármaco sunitinib, el cual, pese a la ventaja que implica su administración por vía oral, provoca más efectos colaterales, pues su acción es sistémica. “Actúa en la porción intracelular de los receptores de VEGF y termina por afectar también a otras proteínas parecidas, como el receptor de la proteína PDGF [el factor de crecimiento derivado de plaquetas, por sus siglas en inglés]. Sin la acción de la PDGF, el vaso se vuelve más frágil y hemorrágico, lo cual puede afectar fundamentalmente al corazón”, explicó el investigador.
En tanto, el péptido PCAIWF, según explicó Giordano, actúa en la porción extracelular de los receptores de VEGF, la parte donde esas proteínas se diferencian más respecto a otras de la misma clase (tirosinas cinasas). De todos modos, de acuerdo con el investigador, los riesgos de efectos adversos no son desdeñables en caso de administración por vía oral, ya que la droga puede tener efectos sobre el proceso fisiológico de angiogénesis en otros tejidos.
“Ahora estamos intentando identificar genes que se expresan únicamente en la angiogénesis patológica en modelos animales, lo que puede abrir el camino hacia el desarrollo de fármacos aún más selectivos”, comentó Giordano.
Puede leerse el artículo intitulado “Discovery of pan-VEGF inhibitory peptides directed to the extracellular ligand-binding domains of the VEGF receptors” (DOI: 10.1126/sciadv.1600611) en el siguiente enlace: advances.sciencemag.org/content/2/10/e1600611.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





