

Resultados de estudios publicados en PNAS abren el camino hacia el desarrollo de inhibidores que podrán ponerse a prueba en parásitos (imagen: divulgación)
Resultados de estudios publicados en PNAS abren el camino hacia el desarrollo de inhibidores que podrán probarse en parásitos
Resultados de estudios publicados en PNAS abren el camino hacia el desarrollo de inhibidores que podrán probarse en parásitos
Resultados de estudios publicados en PNAS abren el camino hacia el desarrollo de inhibidores que podrán ponerse a prueba en parásitos (imagen: divulgación)
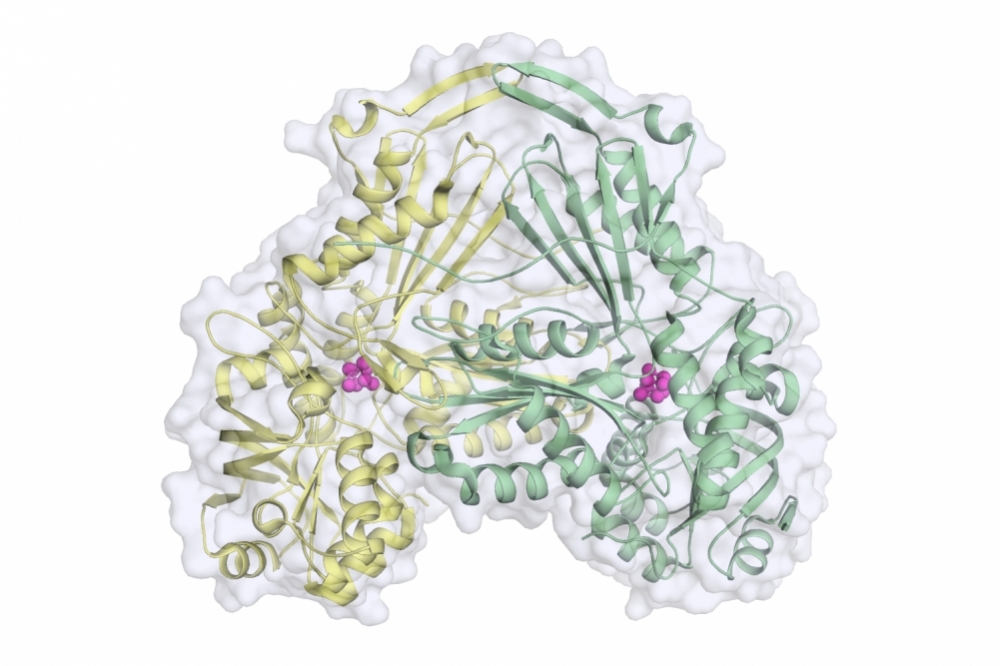
Por Karina Toledo | Agência FAPESP – En un artículo publicado en la revista Proceedings of the National Academy of Sciences (PNAS), investigadores de la Universidad de São Paulo (USP), en Brasil, describieron la estructura de una enzima importante para el metabolismo del protozoo Leishmania major, causante de leishmaniasis cutánea.
Según los autores, los resultados de esta investigación –apoyada por la FAPESP– abren el camino hacia el desarrollo de medicamentos que podrán ser útiles tanto en el tratamiento de los diversos tipos de leishmaniasis como también en el de la enfermedad de Chagas y el de la enfermedad del sueño (la tripanosomiasis africana).
“La proteína hallada en L. major es muy parecida a la existente en el Trypanossoma cruzi [el causante de la enfermedad de Chagas] y en el T. brucei [causante de la enfermedad del sueño]. Por otra parte, es muy diferente a la enzima encontrada en humanos. Esto la convierte en un blanco sumamente interesante para el desarrollo de fármacos”, afirmó Maria Cristina Nonato, docente de la Facultad de Ciencias Farmacéuticas de Ribeirão Preto (FCFRP-USP), en São Paulo, y coordinadora del estudio.
La proteína descrita en el artículo, conocida como fumarato hidratasa, se encarga de catalizar la conversión reversible de malato en fumarato, metabolitos importantes para la supervivencia del parásito.
En humanos, su deficiencia está relacionada con diversas patologías, tales como la aciduria fumárica, considerada un error innato del metabolismo y caracterizada por la pérdida de tono muscular, un retraso psicomotor y convulsiones, entre otros síntomas. Otros ejemplos son la leiomiomatosis cutánea y uterina (neoplasias benignas de la musculatura lisa) y el carcinoma renal.
En el artículo, los investigadores demostraron que, al ovillarse, esta proteína asume un formato tridimensional nunca antes descrito en la literatura científica, que se asemeja a la imagen de un corazón. También se identificaron durante la investigación los principales residuos de aminoácidos implicados en la reacción catalítica. Este conocimiento, según Nonato, permite desarrollar inhibidores de la actividad enzimática que podrán testearse para evaluar su efecto antiparasitario.
Sensible al oxígeno
El trabajo empezó durante los proyectos de maestría y de doctorado de Patrícia Rosa Feliciano, bajo la dirección de Nonato. En ese marco, se desarrollaron las metodologías destinadas a clonar la proteína, expresarla en bacterias y purificarla.
Pero el avance sólo fue posible merced a una colaboración sellada con la investigadora Catherine Drennan, del Massachusetts Institute of Technology (MIT), en Estados Unidos. Sucede que la actividad de la fumarato hidratasa queda inhibida al entrar en contacto con el oxígeno. Por ende, para estudiarla más profundamente, es necesaria una estructura conocida como glove box, una cámara cerrada herméticamente a cuyo interior sólo puede ingresarse mediante el uso de guantes. Dentro de dicha cámara, se inserta nitrógeno para expurgar todo el contenido de oxígeno de su interior.
“Aún no contamos en Brasil con una infraestructura ideal para trabajar con proteínas sensibles al oxígeno. Todo el proceso de purificación y cristalización tendiente a determinar la estructura se realizó en el MIT, en colaboración con Drennan y con el aporte de una Beca de la FAPESP referente a una pasantía en el exterior”, comentó Nonato.
Con la proteína purificada y cristalizada, el grupo logró investigar su estructura tridimensional empleando una técnica conocida como cristalografía por difracción de rayos X.
“Por la forma en que el cristal de proteína difracta la radiación emitida sobre éste es posible descubrir qué tipo de átomo se encuentra presente y su posición en la molécula. Por lo tanto, existe una correlación entre el contenido atómico y el patrón de difracción; y empleamos esa información para reconstruir la estructura de la proteína. Como el cristal contiene innumerables copias de la misma molécula, esto ayuda a amplificar la señal”, explicó Nonato.
Luego el grupo creó versiones mutantes de la proteína, cuya estructura cristalográfica también investigaron, y mapearon su mecanismo catalítico. Los datos de esa segunda parte de la investigación saldrán publicados en poco tiempo más.
“Hemos desarrollado incluso un inhibidor que está funcionando bien, pero aún no contamos con los resultados referentes a sus efectos en los parásitos”, comentó Nonato.
En estudios anteriores, el grupo ya había demostrado que en la L. major se encuentran dos isoformas de fumarato hidratasa: una en la mitocondria y otra en el citosol (el líquido que ocupa el citoplasma celular). Según Nonato, la isoforma mitocondrial estaría implicada en la producción de energía para el parásito.
“Lo interesante es que son dos proteínas muy parecidas, pero con roles distintos en el organismo. Por ende, cuando se las inhibe, se interfiere en más de una vía metabólica. Creemos que de esta forma puede desencadenar efectos mayores que fármacos que interfieren en una sola vía”, sostuvo la investigadora.
La leishmaniasis tegumentaria o cutánea es transmitida a los seres humanos a través de la picadura de flebótomos conocidos como jejenes (género Lutzomyia) y su principal característica es el surgimiento de úlceras en la piel y en las mucosas de las vías aéreas superiores.
En Brasil esta enfermedad es causada fundamentalmente por protozoarios de la especie L. braziliensis. Sin embargo, Nonato desarrolló el estudio con la especie L. major, debido a que de ésta se secuenció el genoma primeramente.
Existen también otras especies de protozoos del mismo género que causan leishmaniasis visceral, que está considerada como una de las seis parasitosis más importantes en humanos.
Puede leerse el artículo intitulado Crystal structure of an Fe-S cluster-containing fumarate hydratase enzyme from Leishmania major reveals a unique protein fold (doi: 10.1073/pnas.1605031113) en el siguiente enlace pnas.org/content/113/35/9804.abstract.
Y pueden consultarse más imágenes e información sobre la enzima fumarato hidratasa de la especie L. major en el sitio web del Laboratorio de Cristalografía de Proteínas: www.lcprp.com.br.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





