

Se trata de un tratamiento contra glioblastomas multiformes de grado IV que combina una molécula fotoactiva y un agente quimioterapéutico, ambos encapsulados en nanopartículas lipídicas proteicas. Antônio Claudio Tedesco presentó este trabajo durante la FAPESP Week France (imagen: Molecular Pharmaceutics)
Se trata de un tratamiento contra glioblastomas multiformes de grado IV que combina una molécula fotoactiva y un agente quimioterapéutico, ambos encapsulados en nanopartículas lipídicas proteicas. Antônio Claudio Tedesco presentó este trabajo durante la FAPESP Week France
Se trata de un tratamiento contra glioblastomas multiformes de grado IV que combina una molécula fotoactiva y un agente quimioterapéutico, ambos encapsulados en nanopartículas lipídicas proteicas. Antônio Claudio Tedesco presentó este trabajo durante la FAPESP Week France
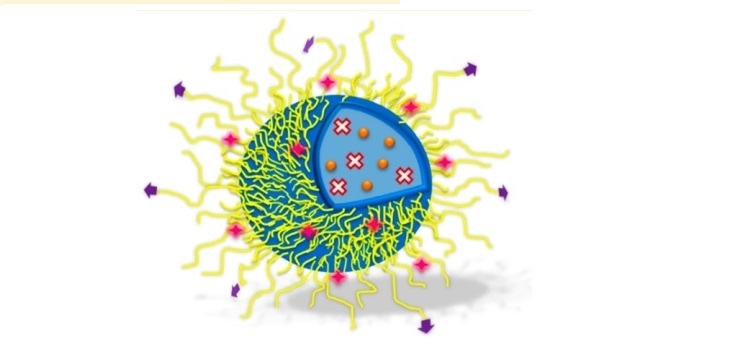
Se trata de un tratamiento contra glioblastomas multiformes de grado IV que combina una molécula fotoactiva y un agente quimioterapéutico, ambos encapsulados en nanopartículas lipídicas proteicas. Antônio Claudio Tedesco presentó este trabajo durante la FAPESP Week France (imagen: Molecular Pharmaceutics)
Maria Fernanda Ziegler, desde París | Agência FAPESP – Investigadores de la Universidad de São Paulo (USP) desarrollaron una estrategia con el objetivo de combatir el tipo más agresivo de cáncer cerebral en adultos, con la cual combinan la acción de una molécula fotoactiva y la de un agente quimioterapéutico, ambos encapsulados en nanopartículas lipídicas proteicas.
Antônio Claudio Tedesco, del Centro de Nanotecnología e Ingeniería Tisular y Fotoprocesos, dependiente del Departamento de Química de la Facultad de Filosofía, Ciencias y Letras de Ribeirão Preto (FFCLRP-USP), dio a conocer los resultados de esta investigación, que contó con el apoyo de la FAPESP, el pasado 26 de noviembre, durante el simposio FAPESP Week France.
Los glioblastomas multiformes de grado IV corresponden a casi el 25% de todos los tumores cerebrales no metastásicos. Esta nueva terapia puede aplicarse antes, durante y después de la cirugía de extracción del tumor, obligatoria en los casos más agresivos de glioblastomas. El uso de nanopartículas lipídicas permite liberar los compuestos activos directamente en el tumor de manera gradual y sostenida durante algunos meses.
“Cuanto menos tejido cerebral se extirpa, más segura resulta la cirugía, pues disminuye considerablemente el riesgo de comprometer las funciones vitales del paciente”, explicó Tedesco.
Datos de experimentos realizados en cultivos de células tumorales salieron publicados en la revista Molecular Pharmaceutics .
El grupo pretende evaluar en poco tiempo más el efecto de este tratamiento en animales; y hacerlo antes, durante y después de la extirpación quirúrgica del tumor. La propuesta consiste en enriquecer la zona afectada con las moléculas fotoactivas alrededor de dos semanas antes de la cirugía. Durante ese período, simultáneamente, el agente quimioterapéutico estará actuando para reducir la masa tumoral.
Durante la cirugía, se aplica la luz para activar los compuestos fotosensibles. “En ese momento, con el retiro del casquete craneal y del tumor, es posible proteger el tejido sano con la fototerapia y matar a las células enfermas que puedan haber quedado impregnadas en el tejido”, dijo el investigador.
En el período posquirúrgico, este nuevo tratamiento puede ayudar a evitar las recidivas, pues las nanopartículas son capaces de liberar en forma sostenida y gradual el agente quimioterapéutico directamente en la zona tumoral, sin provocarles problemas colaterales a los pacientes debilitados.
“Es precisamente durante ese período cuando el 90% de los pacientes padecen recidivas y, normalmente, de manera sumamente agresiva. Sin embargo, como están debilitados, no es posible someterlos a la radioterapia o a la quimioterapia convencional. Con este nuevo método, podemos mantener el combate activo contra la enfermedad durante un mes tras la cirugía”, dijo Tedesco.
El tratamiento quimioterapéutico convencional contra el glioblastoma involucra la administración del fármaco temozolomida, que tiene un costo elevado y pocas garantías de eficacia. Entre los efectos adversos de la dosis necesaria como para atravesar la barrera hematoencefálica –que protege al sistema nervioso central– se cuentan daños en la médula ósea, donde están las células madre hematopoyéticas, responsables de la generación de las células de la sangre y del sistema inmunológico.
Innumerables utilidades
Tedesco remarca que la nanotecnología y los nuevos sistemas de trasmisión de fármacos han permitido que moléculas que antes se utilizaban para el tratamiento de determinadas patologías puedan “rediseñarse” para adaptárselas a nuevas funciones.
De esta forma, el mismo sistema empleado para el tratamiento de glioblastomas puede también aplicarse en el diagnóstico y así suministrar información importante para las cirugías de extirpación de tumores mediante el empleo de un marcador fluorescente.
Actualmente, antes de la cirugía, se emplean imágenes de tomografías o resonancias capaces de detectar la masa tumoral. “El neurólogo decide acerca del margen de seguridad que debe extraerse. Con este nuevo sistema, es posible saber exactamente cuál es la masa que se retirará”, dijo.
Los mismos sistemas de transporte que contienen los componentes activos descritos anteriormente pueden emplearse también para la marcación y el diagnóstico de tipos menos graves de glioblastomas. “Pretendemos poner en práctica el mismo abordaje para identificar a los pacientes con tumores de grado II y III que aún no han llegado al punto de requerir una intervención quirúrgica. Esto es importante para poder tratar la enfermedad antes de que evolucione”, dijo Tedesco.
“En caso de que tengamos que avanzar hacia una cirugía, nuestra idea apunta a que, con la tecnología de impresión de órganos en 3D, que ya se encuentra disponible en el Centro de Nanotecnología, podamos construir una prótesis del tamaño exacto del tumor que se extirpará. Podemos impregnar ese material con el agente quimioterapéutico, para que actúe igual que el anteriormente descrito, es decir, que efectúe una liberación sostenida del compuesto activo durante semanas o meses”, añadió.
El grupo de Tedesco es uno de los pioneros en Brasil en el área de fototerapia dinámica. Los trabajos en este campo empezaron con el tratamiento del cáncer de piel y avanzaron rápidamente hacia un área de la ingeniería tisular y la medicina regenerativa de órganos y tejidos. Entre los estudios que ya se han realizado se encuentran un modelo artificial de piel humana, actualmente elaborado para el tratamiento de quemados y para la cicatrización.
Existen también trabajos con sistemas de transporte de fármacos altamente específicos que pueden emplearse en el tratamiento de enfermedades neurodegenerativas tales como el párkinson, el alzhéimer y la epilepsia.
El simposio FAPESP Week France tuvo lugar entre los días 21 y 27 de noviembre en el marco de colaboración entre la FAPESP y las universidades de Lyon y de París, ambas de Francia. Lea otras noticias sobre este evento en: www.fapesp.br/week2019/france.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





